
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Техническая термодинамика
|
|
Конспект лекций
по курсу «Термодинамика и теплотехника»
для студентов направления подготовки 6.050202
«Автоматизация и компьютерно-интегрированные технологии» (АКТ)
лектор доц. Алексеев В.П.
Техническая термодинамика
Введение.
Цель и задачи курса. Предмет технической термодинамики и её задачи. Основные понятия и определения технической термодинамики.
Техническая термодинамика занимается изучением закономерностей взаимного превращения в основном двух видов энергии (механической и тепловой), физических свойств идеальных и реальных газов, анализом термодинамического совершенства(эффективность работы) работы тепловых двигателей и холодильных машин. Совокупность макроскопических тел, обменивающихся энергией как между собой, так и с окружающей средой называется термодинамической системой. Совокупность изменения состояния термодинамической системы при переходе из одного равновесного состояния в другое называется термодинамическим процессом. Различают равновесные и неравновесные системы. Обратимые и необратимые процессы. В термодинамике (далее слово техническая опускаем) используется как аналитический так и графический метод исследования. Термодинамика базируется на два фундаментальных закона – первый и второй законы. Термодинамические параметры состояния. Основными параметрами являются: абсолютное давление Р (Н/м²); абсолютная температура Т, К(по шкале Кельвина) и удельный объем. На практике находит применение шкала Цельсия (t, °C).
T = t + 273; t = T – 273
Рабс = Ризб + Ратм; Рабс = Ратм – Рвак.
Тема 1. Законы и уравнения состояния идеальных и реальных газов.
Закон Бойля-Мариотта: в процессе, протекающем при постоянной температуре
T = const, отношение давлений изменяется обратно пропорционально отношению удельных объемов P2/P1 = υ1/υ2, P1υ1 = P2υ2; Pυ = const.
Закон Гей-Люссака: в процессе, протекающем при постоянном давлении, отношение удельных объемов изменяется прямо пропорционально отношению абсолютных температур υ2/υ1 = T2/T1 или υ1/T1 = υ2/T2; υ/T = const.
В процессе, протекающем при постоянном объеме V=const (закон Шарля), отношение давлений изменяется прямо пропорционально отношению абсолютных температур P2/P1 = Т2/Т1 или Р1/T1 = Р2/T2; Р/T = const.
Газ, в котором не учитываются силы взаимодействия между молекулами и объем самих молекул называется идеальным. Уравнение состояния идеальных газов Клапейрона и Менделеева – Клапейрона
Pυ=RT; PV=mRT; PVμ=μRT
P – абсолютное давление, Па (Н/м²);
Т – абсолютная температура,К;
υ – удельный объем, м³/кг;
V – объем, м³; Vμ – объем одного Кмоля газа; m - масса газа, кг;
R – газовая постоянная, Дж /(кг·К);
μR = 8314 Дж/(кмоль·К) – универсальная газовая постоянная.
Уравнения реальных газов:
Уравнение Боголюбова-Майера
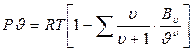 (1)
(1)
где: 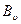 - вириальные коэффициенты выражаются через потенциальную энергию взаимодействия молекул данного газа и температуру Т,
- вириальные коэффициенты выражаются через потенциальную энергию взаимодействия молекул данного газа и температуру Т,
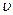 - порядковый номер вириального коэффициента.
- порядковый номер вириального коэффициента.
Уравнение Ван-дер-Ваальса
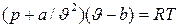 (2)
(2)
где: 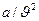 - поправка, учитывающая внутреннее давление газа, обусловленное силами взаимодействия между молекулами (потенциальная составляющая);
- поправка, учитывающая внутреннее давление газа, обусловленное силами взаимодействия между молекулами (потенциальная составляющая);
b – поправка учитывает объем самих молекул;
а – коэффициент, принимающий для каждого газа определенное числовое значение, не зависящий от параметров состояния.
Уравнение Вукаловича-Новикова
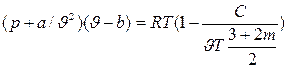 (3)
(3)
где: С и m – постоянные, определяемые на основании опытных данных.
Тема 2. Первый и второй законы термодинамики
Первый закон термодинамики устанавливает количественные соотношения между теплотой и работой и является частным случаем общего закона природы, закона сохранения и превращения энергии.
Дифференциальные уравнения первого закона для 1 кг рабочего тела имеют вид:
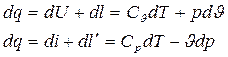
(4)
(5)
Подведенная теплота расходуется на изменение внутренней энергии и на совершение внешней работы (формула 4).
q – удельная теплота, КДж/кг;
l – удельная работа изменения объема, КДж/кг;
l´ - удельная располагаемая работа, КДж/кг;
U и i – соответственно удельная внутренняя энергия и энтальпия, КДж/кг;
Ср и Сυ – изобарная и изохорная удельные массовые теплоемкости, КДж/(кг·К).
Сущность второго закона (формулировка Томсона и Клаузиуса): «Не вся теплота, полученная от тепоотдатчика, может перейти в работу, а только некоторая ее часть. Часть теплоты должна перейти в теплоприемник (Томсон).» «Теплота не может переходить от холодного тела к более нагретому сама собой даровым процессом (без компенсации).
Следовательно «осуществление вечного двигателя второго рода невозможно» (Освальд). Под вечным двигателем второго рода подразумевается такой двигатель, который способен полностью превращать в работу всю теплоту, полученную только от одного источника.
Тема 3. Термодинамические процессы.
1. Изохорный процесс. Процесс, протекающий при постоянном объеме называется изохорным. υ=const. Линия в диаграммах называется изохорой (справедлив закон Шарля). P2/P1 = Т2/Т1; Р/T = const.
В изохорном процессе работа изменения объема равна нулю. 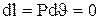 , тогда
, тогда 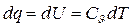 или
или  .
.
2. Изобарный процесс. Процесс, протекающий при постоянном давлении называется изобарным. P=const. Линия в диаграммах называется изобарой (справедлив закон Гей-Люссака) P = const; υ2/υ1 = T2/T1; υ/T = const. В изобарном процессе располагаемая работа равна нулю.
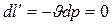 , тогда
, тогда 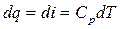 или
или 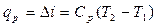
3. Изотермный процесс. Процесс, протекающий при постоянной температуре называется изотермным. T=const. Линия в диаграммах называется изотермой (справедлив закон Бойля-Мариотта).
T=const; P2/P1 = υ1/υ2, P1υ1 = P2υ2; Pυ = const.
В изотермном процессе изменения внутренней энергии и энтальпии равны 0 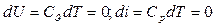 . Следовательно, из уравнения первого закона термодинамики следует
. Следовательно, из уравнения первого закона термодинамики следует 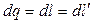 ;
; 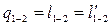 , то есть количество теплоты, работа изменения объема и располагаемая работа численно равны.
, то есть количество теплоты, работа изменения объема и располагаемая работа численно равны.
4. Адиабатный процесс. Процесс, протекающий без теплообмена с окружающей средой (т.е. к системе теплота не подводится и от системы теплота не отводится) dq=0. Тогда из уравнения первого закона следует dU+dl=0; dU=-dl или
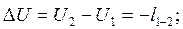
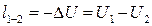
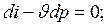
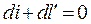 ;
; 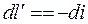
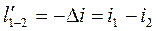
Уравнение адиабатного процесса 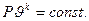
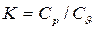 - показатель адиабаты.
- показатель адиабаты.
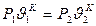 ;
; 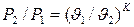 ;
; 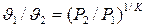
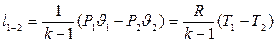 ;
;
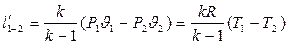 ;
;
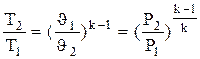
5. Политропные процессы. Процесс, протекающий при постоянной теплоемкости, называется политропным. Уравнение политропного процесса 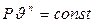 . n – показатель политропы. Изохорный (n=±
. n – показатель политропы. Изохорный (n=± 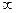 ), изобарный (n=0), изотермный (n=1), адиабатный (n=k) процессы являются частным случаем политропного процесса, если они протекают при постоянной теплоемкости. Для политропного процесса справедливы вышеприведенные формулы для адиабатного процесса при замене показателя адиабаты “k” на показатель политропы “n”.
), изобарный (n=0), изотермный (n=1), адиабатный (n=k) процессы являются частным случаем политропного процесса, если они протекают при постоянной теплоемкости. Для политропного процесса справедливы вышеприведенные формулы для адиабатного процесса при замене показателя адиабаты “k” на показатель политропы “n”.
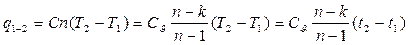 (6)
(6)
Тема 4. Процессы водяного пара. Влажный воздух.
Процесс парообразования, который происходит при любой температуре и с поверхности жидкости называется испарением. Процесс парообразования протекающий при определенной температуре и не только с поверхности жидкости, но и с внутренних слоев жидкости называется кипением. Пар, соприкасающийся с жидкостью и находящийся в термическом с ней равновесии, называется насыщенным. Насыщенный пар, в котором содержатся высокодисперсные частицы жидкости, равномерно распределенные по всей массе пара, называется влажным насыщенным.
Массовая доля сухого насыщенного пара во влажном называется степенью сухости (х), а массовая доля кипящей жидкости во влажном паре (1-х) называется степенью влажности.
Насыщенный пар, в котором отсутствуют высокодисперсные (мельчайшие) частицы жидкой фазы, называется сухим насыщенным. Кипящая жидкость (х=0), сухой насыщенный пар (х=1), влажный насыщенный пар 0<x<1. Пар, имеющий при данном давлении более высокую температуру, чем сухой насыщенный пар, называется перегретым.
Количество теплоты которое необходимо затратить, чтобы 1 кг воды при температуре кипения перевести в сухой насыщенный пар, называется удельной теплотой парообразования.
Смесь сухого воздуха и водяных паров называют влажный воздух. Влажный воздух может быть насыщенный и ненасыщенный. Масса водяных паров, содержащихся в 1 м³ влажного воздуха, численно равная плотности пара ρп при парциальном давлении Рп называется абсолютной влажностью. Отношение действительной абсолютной влажности ненасыщенного воздуха к максимально возможной абсолютной влажности воздуха при той же температуре называется относительной влажностью.
φ=ρп / ρмакс; φ=0 (сухой воздух); φ=1 (воздух насыщенный)
Относительная влажность воздуха, если его считать идеальным газом, можно выразить через парциальное давление водяного пара в нем. φ=Рп / Рмакс
Отношение массы пара m п во влажном воздухе к массе сухого воздуха m в в нем называют влагосодержанием. d= mп / mв или d= ρп / ρв.
Следовательно влагосодержание есть масса пара в 1 кг сухого воздуха или (1+d) кг влажного воздуха. Температура, при которой ненасыщенный воздух становится насыщенным при данном парциальном давлении пара, называется температурой точки росы (tp). Температура точки росы определяется с помощью гигрометра, а парциальное давление пара Рп – с помощью психрометра.
Date: 2015-05-08; view: 826; Нарушение авторских прав