
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

І. Теоретичні відомості. Для якісного та кількісного аналізу речовини в лабораторній практиці широко застосовують спектральні методи дослідження
|
|
Для якісного та кількісного аналізу речовини в лабораторній практиці широко застосовують спектральні методи дослідження. Спектральні методи ґрунтуються на тому, що кожна речовина має свій характерний спектр випромінювання та поглинання. Пояснення лінійчатих спектрів стало можливим після того як Нільс Бор сформулював наступні постулати:
1) електрон в атомі має низку дискретних дозволених енергетичних станів (стаціонарних станів), перебуваючи в яких він не випромінює і не поглинає енергію;
2) випромінювання і поглинання енергії може відбуватися тільки при переході електрона з одного стаціонарного стану (рівня) Е 1 в інший Е 2. При цьому енергія фонона h v, який випромінюється або поглинається, дорівнює різниці енергій початкового і кінцевого станів (рис.1):
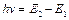 . (1)
. (1)
 З усіх можливих орбіт електрона стаціонарним станам відповідають ті, для яких момент імпульсу кратний числу
З усіх можливих орбіт електрона стаціонарним станам відповідають ті, для яких момент імпульсу кратний числу  . Тому умова квантування орбіт запишеться як
. Тому умова квантування орбіт запишеться як
m×u×r = h× n, (2)
де m – маса електрона; u – швидкість електрона; r – радіус дозволеної колової орбіти електрона; n = 1, 2, 3 ,... – головне квантове число. Оскільки між негативно зарядженим електроном та позитивно зарядженим ядром діє сила кулонівського притягання, то умова рівноваги сили Кулона та доцентрової сили (у вакуумі) запишеться:
 , (3)
, (3)
де Ze – заряд ядра, е – заряд електрона; e0 – діелектрична стала. З (2) і (3) знайдемо швидкість електрона на стаціонарній орбіті:
 . (4)
. (4)
Підставивши (4) у (2), знайдемо радіус n -ї орбіти:
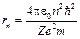 . (5)
. (5)
Тоді повна енергія електрона у водневоподібному атомі складається з його кінетичної енергії (Ze 2/(8pe0 r)) та потенціальної енергії в електростатичному полі ядра (– Ze 2/(4pe0 r)):
 . (6)
. (6)
Врахувавши квантовані значення радіуса для n -ї орбіти електрона (5), отримаємо:
 . (7)
. (7)
Знак “–“ означає, що електрон перебуває у зв’язаному стані. Зазначимо ще раз, що ціле число n, яке у (7) визначає енергетичні рівні атома, називається головним квантовим числом. Енергетичний стан з n = 1 є основним (нормальним, незбудженим) станом, стани з n > 1 – збудженими. Енергія, що відповідає основному стану атома водню (Z = 1, n = 1), дорівнює –13,55 еВ. Це енергія, яку необхідно надати, щоб вивести електрон за межі атома. Тому її ще називають енергією іонізації.
Користуючись правилом частот Бора (1), визначимо частоту світлової хвилі, що випромінюється атомом при переході з вищого рівня (n = ni) на нижчий (n = nk):
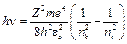 , (8)
, (8)
або
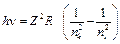 , (9)
, (9)
де  – стала Рідберга. Перехід електрона на перший енергетичний рівень (nk = 1, ni = 2, 3, 4,…) утворює серію Лаймана; на другий (nk = 2, ni = 3, 4, 5,…) - серію Бальмера; на третій (nk = 3, ni = 4, 5, 6,…) - серію Пашена. Таким чином формула (9), виведена Бором, пояснила походження спектральних серій.
– стала Рідберга. Перехід електрона на перший енергетичний рівень (nk = 1, ni = 2, 3, 4,…) утворює серію Лаймана; на другий (nk = 2, ni = 3, 4, 5,…) - серію Бальмера; на третій (nk = 3, ni = 4, 5, 6,…) - серію Пашена. Таким чином формула (9), виведена Бором, пояснила походження спектральних серій.
Оптичні спектри складних атомів утворюються валентними електронами, які при переході з вищих на нижчі стаціонарні орбіти, випромінюють кванти світла, а при переході з нижчих на вищі стаціонарні орбіти поглинають їх.
Зі спектра можна визначити, електрони якого атома випромінюють електромагнітні хвилі. Для цього треба виміряти довжини хвиль найбільш інтенсивних ліній, що наявні в досліджуваному спектрі, і за допомогою спеціальних таблиць знайти речовину, спектр якої характеризується довжинами таких хвиль.
Date: 2015-05-08; view: 697; Нарушение авторских прав