
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коэффициент сверхсжимаемости (сжимаемости) реальных газов
|
|
Для определения многих физических свойств природных газов (коэффициента сжимаемости, плотности, энтальпии, энтропии, коэффициента летучести и др.) используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающая поведение простого или сложного вещества. В качестве таких параметров используется давление, объём и температура.
Менделеев-Клайперон предложили следующее уравнение состояния идеальных газов:
pV = GRT,
где p – абсолютное давление, Па; V – объём, м3; G – масса вещества, кг; T – абсолютная температура, К; R – удельная газовая постоянная, кДж/(кг·К).
Идеальным называют газ, силами взаимодействия между молекулами которого пренебрегают.
С термодинамической точки зрения идеальным называется газ, для которого справедливы равенства:
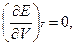
где Е – внутренняя энергия преобразования, Дж/моль.
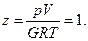
Здесь z – коэффициент, характеризующий степень отклонения реального газа от закона идеальных газов (коэффициент сверхсжимаемости).
Экспериментально доказано, что все реальные газы не подчиняются закону идеальных газов.
Реальные природные газы – физические смеси большого числа углеводородных и неуглеводородных компонентов, простых и сложных газов. Молекулы простых газов (метан, гелий, аргон, криптон и др.) имеют сферическую форму, а молекулы сложных газов и жидкостей – несферическую. Для простых газов силы притяжения, действующие вдоль линии, соединяющей центры сферических молекул, пропорциональны расстоянию в шестой степени. Для сложных газов и жидкостей силы притяжения (или отталкивания) между различными группами молекулярных пар не могут быть представлены лишь одной силой притяжения между центрами молекул. Для учёта других, нецентрических сил вводится ацентрический фактор ω. Он является третьим после приведённого давления и температуры параметром, оценивающим меру отклонения коэффициента сверхсжимаемости природных газов от его значения, определяемого классической двух параметрической теоремой соответственных состояний:
z = z (p пр, T пр, ω),
Или
z см = z 0(p пр, T пр) + z1 (p пр, T пр) ωсм,
где z 0(p пр, T пр) – коэффициент сверхсжимаемости простого газа, определяемый p пр и T пр при ω=0; z1 (p пр, T пр) – поправка к обобщённому коэффициенту сверхсжимаемости сложных газов и жидкостей, являющаяся функцией только приведённого давления и температуры; ωсм – ацентрический фактор смеси газов,
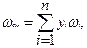
где ω i – ацентрический фактор i –го компонента смеси. Часто он определяется по формуле Эдмистера:
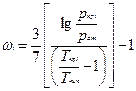
Здесь p ат – атмосферное давление; Т кип – температура кипения компонента при атмосферном давлении.
Date: 2015-06-08; view: 1515; Нарушение авторских прав