
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Розвиток уявлень про будову речовини
|
|
Основні положення МКТ. Тепловий рух.
Основою молекулярної фізики є молекулярно-кінетична теорія.
Перші уявлення про молекулярну будову речовини зародилися в глибоку давнину. Уже більше двох тисяч років тому давньогрецькі філософи передбачали що все в світі складається з дуже маленьких неподільних частинок – атомів. Грецький вчений Демокріт (460-370 рр. до н.е.) писав: «Все складається з атомів…. речі розрізняються атомами, з яких складаються, їх порядком і положенням». Хоча слід зауважити, що уявлення стародавніх атомістів про дискретну будову речовини були лише здогадкою.
В середні віки послідовники атомістичного вчення переслідувалися інквізицією і владою, бо було глибоко матеріалістичним. У Франції в 1026 році вищій суд заборонив спеціальним декретом розповсюдження атомістичного учення під страхом смертної втрати. Лише в XVII столітті І. Ньютон зробив спробу пояснити розширення газів на основі передбачення, що молекули намагаються заповнити простір.
В XVIIІ столітті прихильником і пропагандистом молекулярно-кінетичної теорії був М. Ломоносов. Основні положення цієї теорії, сформульовані Ломоносовим, не зазнали суттєвих змін і до нашого часу.
Мета молекулярно-кінетичної теорії - пояснення властивостей макроскопічних тіл і теплових процесів, які протікають в них, на основі уявлень про те, що всі тіла складаються з окремих частинок, які хаотично рухаються.
Основні положення МКТ речовини:
1. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів.
Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо.
Молекули - найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок - атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 108 елементів.
Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент має свій номер Z в таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра.
2. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
3. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих - відштовхуються. Сили притягання і відштовхування між молекулами діють постійно.
Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють три стани речовини: твердий, рідкий, газоподібний (плазма).
2. Доведення існування молекул.
Молекулярно-кінетичну теорію речовини підтверджено такими дослідами і спостереженнями:
- дослід із змішуванням рідин;
- дослід із розчиненням твердих речовин в рідинах;
- спостереження над стисливістю речовин;
- деформації твердих тіл;
- броунівський рух;
- спостереження дифузії;
- зображення окремих молекул, отримані за допомогою іонного проектора, електронного мікроскопа;
- рентгеноструктурний аналіз речовин;
- спостереження осмосу.
Англійський ботанік Роберт Броун 1827 року відкрив хаотичний рух спори плауна у воді. Рух завислих частинок відбувався внаслідок руху молекул. Такого ж руху зазнають частинки фарби у воді, пилинки в промені світла тощо. Молекули передають частинкам імпульс, а отже, чинять на частинки тиск.
Перегляд відео сюжету «Броунівський рух».
1905 року Ейнштейн розробив кількісну теорію броунівського руху.
Дифузія - явище спонтанного проникнення молекул контактуючих речовин в міжмолекулярні проміжки кожної з них.
Дифузію, що відбувається через напівпроникні перегородки, називають осмосом.
Приклад дифузії в газах - виникнення запаху, у рідинах - переміщування рідин різної густини. Молекули золота і свинцю внаслідок дифузії протягом 5 років утворюють шар завтовшки 1 см.
З підвищенням температури швидкість дифузії зростає. У природі дифузія сприяє живленню рослин з ґрунту. Без дифузії життя було б неможливим, адже насичення крові киснем і відведення шкідливих речовин - теж дифузія.
Довести існування значних сил притягання між атомами або молекулами можна, зокрема, за допомогою досліду з товстою палицею, яку важко зламати. Але одні лише сили притягання не можуть забезпечити існування стійких атомів й молекул.
Перегляд відео сюжету «Дифузія».
Завдяки силам відштовхування молекули не проникають одна в одну.
Хоч молекули електронейтральні, між ними на малих відстанях діють значні електричні сили, бо молекула - складна система, що складається з електронів і ядер атомів. Відбувається взаємодія між електронами і ядрами сусідніх молекул.
3. Оцінка розмірів і кількості молекул в тілах.
Як визначити діаметр молекули?
Об’єм 1 мм  олії розпливається на поверхні води і займає площу 0,6 м
олії розпливається на поверхні води і займає площу 0,6 м  .
.
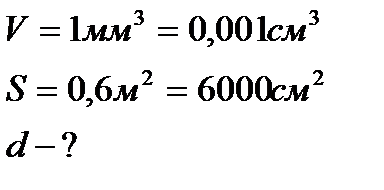
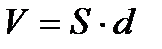 ;
; 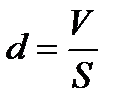 ;
; 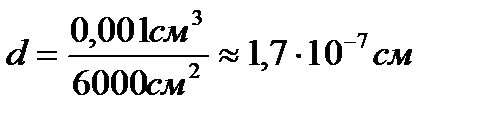
Діаметр молекули води приблизно 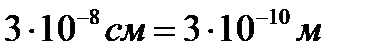
Знайти кількість молекул у краплі води масою 1 г і об’ємом 1 см 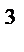 .
.
Об’єм однієї молекули води приблизно 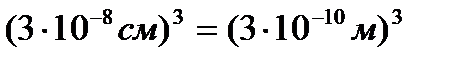 .
.
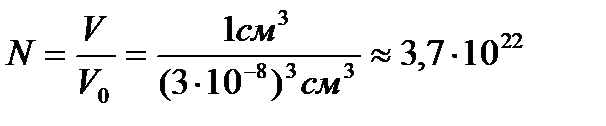 .
.
Розміри атома: D = 10 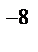 см = 10
см = 10 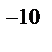 м.
м.
4. Визначення маси молекули. Число Авогадро. Розв’язування задач.
З курсу хімії 8 класу вам відомо, що за одиницю вимірювання маси атомів і молекул прийнята атомна одиниця маси (а.о.м.). атомну одиницю обрали так, щоб маса найбільш поширеного ізотопу вуглецю була точно в 12 раз більша за цю одиницю. Іншими словами, атомна одиниця маси дорівнює 1/12 маси найбільш поширеного ізотопу вуглецю.
Масу атома, виражену в атомних одиницях маси, називають відносною атомною масою  .
.
Відносною атомною масою речовини 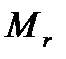 називають відношення маси атома
називають відношення маси атома 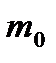 даної речовини до 1/12 маси атома вуглецю
даної речовини до 1/12 маси атома вуглецю 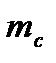 :
:
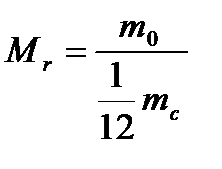 , яке показує, у скільки разів маса атома
, яке показує, у скільки разів маса атома 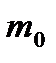 даного елемента більша за 1/12 маси атома вуглецю
даного елемента більша за 1/12 маси атома вуглецю 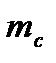 .
.
Відносні атомні маси елементів вказані у періодичній таблиці Менделєєва.
Експериментально встановлено, що атомна одиниця маси дорівнює 1,66∙10 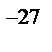 кг.
кг.
Наприклад: СО 
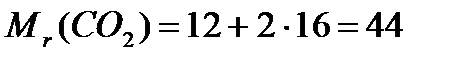
Відносне число атомів чи молекул в тілі називають кількістю речовини.
Кількістю речовини  називають відношення числа молекул
називають відношення числа молекул  в даному тілі до числа
в даному тілі до числа 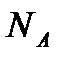 атомів в 0,012 кг вуглецю:
атомів в 0,012 кг вуглецю: 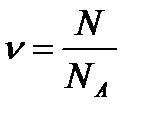 . Вимірюють кількість речовини в молях.
. Вимірюють кількість речовини в молях.
Моль – кількість речовини, яка містить стільки ж молекул, скільки атомів міститься в 0,012 кг вуглецю.
Наприклад, 1 моль водню 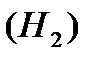 міститься в 2 г водню, 1 моль кисню
міститься в 2 г водню, 1 моль кисню 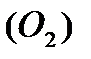 - в 32 г кисню.
- в 32 г кисню.
Масу 1 моль речовини називають молярною масою і позначають М. Одиницею молярної маси служить 1 кг/моль.
 - число Авогадро.
- число Авогадро.
Кількість речовини: 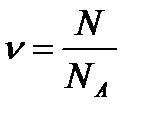 , або
, або 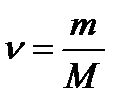 . Молярна маса:
. Молярна маса: 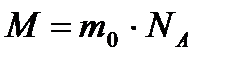 .
.
Маса речовини: 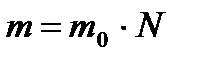 . Кількість молекул:
. Кількість молекул: 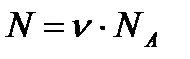 , або
, або 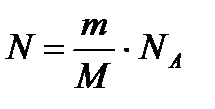 .
.
Розв’язування задач.
№1. Чому дорівнює молярна маса цукру, формула якого 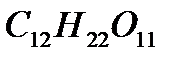 ?
?
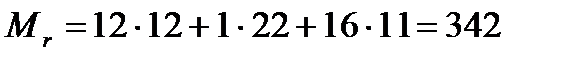
Тоді молярна маса цукру дорівнює: 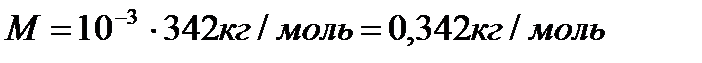 .
.
№2. Визначити масу молекули кисню, метану.
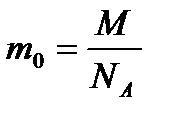 .
. 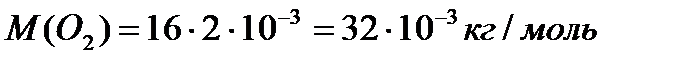
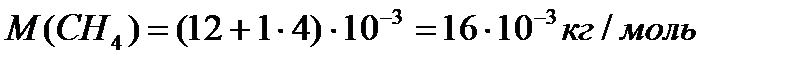
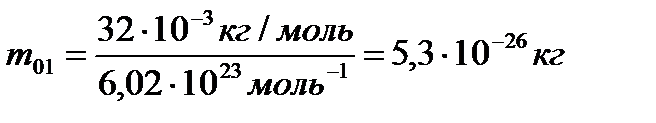
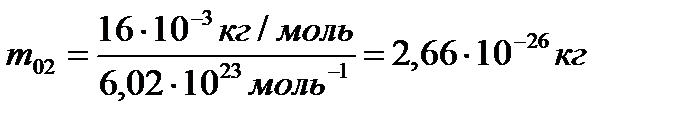
№3. Яка кількість речовини міститься в алюмінієвому виливку масою 5,4 кг?
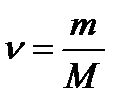
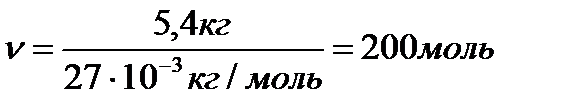
№4. Яка маса 50 молів вуглекислого газу?
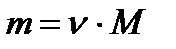
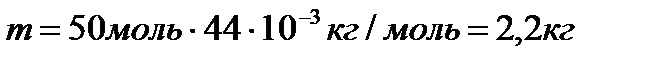
№5. Який об’єм займають 100 молів вуглекислого газу?
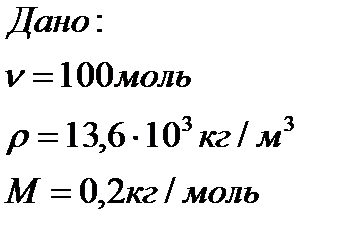
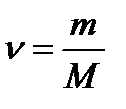 ;
;  ;
; 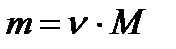 ;
; 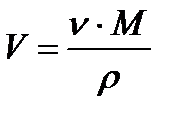 .
.
| <== предыдущая | | | следующая ==> |
| Оценка эффективности рекламы | | | Основные положения гуманистической этико – педагогической концепции Н.Е. Щурковой |
Date: 2015-06-06; view: 1565; Нарушение авторских прав