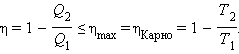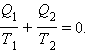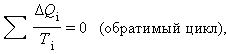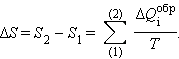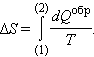Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой
|
|
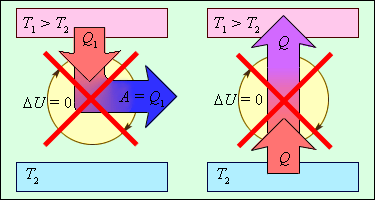
На рис. 3.12.2 изображены процессы, запрещаемые вторым законом, но не запрещаемые первым законом термодинамики. Эти процессы соответствуют двум формулировкам второго закона термодинамики.
|
| Рисунок 3.12.2. Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – «вечный двигатель второго рода»; 2 – самопроизвольный переход тепла от холодного тела к более теплому («идеальная холодильная машина»). |
Следует отметить, что обе формулировки второго закона термодинамики эквивалентны. Если допустить, например, что тепло может самопроизвольно (то есть без затраты внешней работы) переходить при теплообмене от холодного тела к горячему, то можно прийти к выводу о возможности создания «вечного двигателя второго рода». Действительно, пусть реальная тепловая машина получает от нагревателя количество теплоты Q1 и отдает холодильнику количество теплоты Q2. При этом совершается работа A = Q1 – |Q2|. Если бы количество теплоты |Q2| самопроизвольно переходило от холодильника к нагревателю, то конечным результатом работы реальной тепловой машины и «идеальной холодильной машины» было бы превращение в работу количества теплоты Q1 – |Q2|, полученного от нагревателя без какого-либо изменения в холодильнике. Таким образом, комбинация реальной тепловой машины и «идеальной холодильной машины» равноценна «вечному двигателю второго рода». Точно также можно показать, что комбинация «реальной холодильной машины» и «вечного двигателя второго рода» равноценна «идеальной холодильной машине».
Второй закон термодинамики связан непосредственно с необратимостью реальных тепловых процессов. Энергия теплового движения молекул качественно отличается от всех других видов энергии – механической, электрической, химической и т. д. Энергия любого вида, кроме энергии теплового движения молекул, может полностью превратиться в любой другой вид энергии, в том числе и в энергию теплового движения. Последняя может испытать превращение в любой другой вид энергии лишь частично. Поэтому любой физический процесс, в котором происходит превращение какого-либо вида энергии в энергию теплового движения молекул, является необратимым процессом, то есть он не может быть осуществлен полностью в обратном направлении.
Общим свойством всех необратимых процессов является то, что они протекают в термодинамически неравновесной системе и в результате этих процессов замкнутая система приближается к состоянию термодинамического равновесия.
На основании любой из формулировок второго закона термодинамики могут быть доказаны следующие утверждения, которые называются теоремами Карно:
- Коэффициент полезного действия тепловой машины, работающей при данных значениях температур нагревателя и холодильника, не может быть больше, чем коэффициент полезного действия машины, работающей по обратимому циклу Карно при тех же значениях температур нагревателя и холодильника.
- Коэффициент полезного действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Таким образом, коэффициент полезного действия машины, работающей по циклу Карно, максимален.
|
Знак равенства в этом соотношении соответствует обратимым циклам. Для машин, работающих по циклу Карно, это соотношение может быть переписано в виде
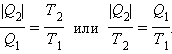
|
В каком бы направлении ни обходился цикл Карно (по или против часовой стрелки), величины Q1 и Q2 всегда имеют разные знаки. Поэтому можно записать
|
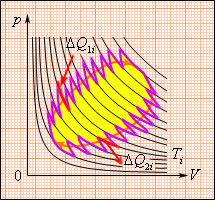
Это соотношение может быть обобщено на любой замкнутый обратимый процесс, который можно представить как последовательность малых изотермических и адиабатических участков (рис. 3.12.3).
|
| Рисунок 3.12.3. Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков. |
При полном обходе замкнутого обратимого цикла
|
где ΔQi = ΔQ1i + ΔQ2i – количество теплоты, полученное рабочим телом на двух изотермических участках при температуре Ti. Для того, чтобы такой сложный цикл провести обратимым путем, необходимо рабочее тело приводить в тепловой контакт со многими тепловыми резервуарами с температурами Ti. Отношение ΔQi / Ti называется приведенным теплом. Полученная формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Эта формула позволяет ввести новую физическую величину, которая называется энтропией и обозначается буквой S (Р. Клаузиус, 1865 г.). Если термодинамическая система переходит из одного равновесного состояния в другое, то ее энтропия изменяется. Разность значений энтропии в двух состояниях равна приведенному теплу, полученному системой при обратимом переходе из одного состояния в другое.
|
В случае обратимого адиабатического процесса ΔQi = 0 и, следовательно, энтропия S остается неизменной.
Выражение для изменения энтропии ΔS при переходе неизолированной системы из одного равновесного состояния (1) в другое равновесное состояние (2) может быть записано в виде
|
Энтропия определена с точностью до постоянного слагаемого, так же, как, например, потенциальная энергия тела в силовом поле. Физический смысл имеет разность ΔS энтропии в двух состояниях системы. Чтобы определить изменение энтропии в случае необратимого перехода системы из одного состояния в другое, нужно придумать какой-нибудь обратимый процесс, связывающий начальное и конечное состояния, и найти приведенное тепло, полученное системой при таком переходе.
Рис. 3.12.4 иллюстрирует необратимый процесс расширения газа «в пустоту» в отсутствие теплообмена. Только начальное и конечное состояния газа в этом процессе являются равновесными, и их можно изобразить на диаграмме (p, V). Точки (a) и (b), соответствующие этим состояниям, лежат на одной изотерме. Для вычисления изменения ΔS энтропии можно рассмотреть обратимый изотермический переход из (a) в (b). Поскольку при изотермическом расширении газ получает некоторое количество теплоты от окружающих тел Q > 0, можно сделать вывод, что при необратимом расширении газа энтропия возросла: ΔS > 0.
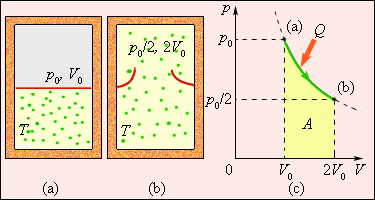
|
Рисунок 3.12.4.
Расширение газа в «пустоту». Изменение энтропии 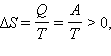 где A = Q – работа газа при обратимом изотермическом расширении. где A = Q – работа газа при обратимом изотермическом расширении.
|
Другой пример необратимого процесса – теплообмен при конечной разности температур. На рис. 3.12.5 изображены два тела, заключенные в адиабатическую оболочку. Начальные температуры тел T1 и T2 < T1. При теплообмене температуры тел постепенно выравниваются. Более теплое тело отдает некоторое количество теплоты, а более холодное – получает. Приведенное тепло, получаемое холодным телом, превосходит по модулю приведенное тепло, отдаваемое горячим телом. Отсюда следует, что изменение энтропии замкнутой системы в необратимом процессе теплообмена ΔS > 0.
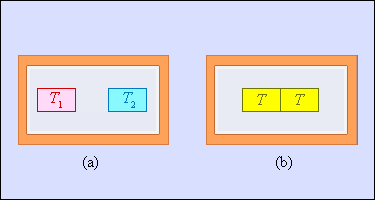
|
| Рисунок 3.12.5. Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии ΔS > 0. |
Рост энтропии является общим свойством всех самопроизвольно протекающих необратимых процессов в изолированных термодинамических системах. При обратимых процессах в изолированных системах энтропия не изменяется:
|
Это соотношение принято называть законом возрастания энтропии.
Date: 2015-05-04; view: 828; Нарушение авторских прав