
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Стандартная энергия Гиббса образования
Под стандартной энергией Гиббса образования Δ G ообр понимают изменение энергии Гиббса при реакции образования 1 моль сложного вещества, находящегося в стандартном состоянии из простых веществ. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для реакции вида
а А + b В +... → с С + d D + …
изменение стандартной энергии Гиббса Δ G о равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
Δ G о=[c ∆ G о(C) + d ∆ G о(D) + …] – [a ∆ G о(A) + b ∆ G о(B) + …],
или
Δ G о = Σ∆ G ообр, прод. – Σ∆ G ообр, исх.
Есть случаи, когда реакция термодинамически разрешена, а самопроизвольно не идёт. Например:
2H2(г) + O2 (г) = 2H2O(ж), Δ G = – 474,38 кДж
В обычных условиях эта реакция практически не идёт. Но стоит внести в смесь подходящий катализатор (мелкодисперсную платину) или просто поднести горящую спичку, реакция произойдёт со взрывом: это гремучий газ.
Если реакция термодинамически не разрешена, условия подобрать невозможно.
6. КОНСТАНТА РАВНОВЕСИЯ И ИЗОБАРНО–ИЗОТЕРМИЧЕСКИЙ ПОТЕНЦИАЛ РЕАКЦИИ
Константа химического равновесия зависит от природы реагентов и температуры. Она связана с изменением стандартной энергии Гиббса химической реакции Δ G о уравнением
Δ G о = –RT ln K, Δ G о298 (кДж) = –5,71 lg K298 (7)
Приведённое уравнение позволяет по величине Δ G о вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Большим отрицательным значениям Δ G о (Δ G <<0) отвечают большие значения К (К>>1), т.е. в равновесной смеси преобладают продукты взаимодействия. При больших положительных значениях Δ G о (Δ G о>>0) в равновесной смеси преобладают исходные вещества (К<<1). Если учесть, что Δ G = Δ Н – T Δ S = –RT lnK, то после некоторого преобразования получим
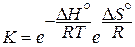
(8)
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических – её уменьшению. От давления (если оно не очень велико) константа равновесия не зависит.
Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на нее природы реагентов.
В литературе применяются термины–синонимы: свободная энергия, свободная энергия при постоянном давлении, потенциал Гиббса, функция Гиббса, энергия Гиббса, изобарный потенциал, изобарно–изотермический потенциал.
7. ТЕРМОХИМИЧЕСКИЕ ИЗМЕРЕНИЯ И ВЫЧИСЛЕНИЯ
Измерение тепловых эффектов называется калориметрией. Методика и оборудование, применяемые в калориметрии, зависят от характера изучаемого процесса. Реакции горения обычно изучают при помощи так называемой калориметрической бомбы. Реакции в калориметрической бомбе протекают при постоянном объеме.
Большинство реакций осуществляется при постоянном давлении. Измерение изменения энтальпии этих реакций осуществляется в калориметрах различных конструкций, которые представляют собой по возможности лучше изолированный от теплообмена с внешней средой сосуд с мешалкой и термометром.
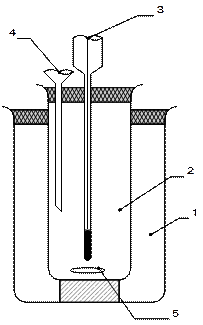
Упрощенный калориметр (рис.3) состоит из двух стаканов: наружного (1) и внутреннего, реакционного (2).
Реакционный стакан с магнитной мешалкой (5) закрывается крышкой с отверстиями: для термометра (3); для воронки (4).
Рис. 3. Устройство калориметра
Количество теплоты, выделяющейся или поглощающейся в калориметре, определяется по формуле
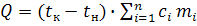 , (9)
, (9)
где tк – конечная температура;
tн– начальная температура;
сi– удельные теплоемкости калориметрического сосуда, калориметрической жидкости и исследуемого вещества;
mi – массы реакционного сосуда, жидкости и исследуемого вещества.
При использовании стеклянного реакционного сосуда теплоемкостью калориметрического сосуда можно пренебречь из-за его малой теплопроводности. Удельную теплоемкость растворов можно принять равной теплоемкости для воды: 4,2 кДж/кг град или 1 ккал/кг·град.
Тогда уравнение (10) примет следующий вид для стеклянного сосуда:
Q = (tк – tн)∙4,2·m (кДж) или
(10)
Q = (tк – tн)∙1·m (ккал),
где m–масса воды растворенного вещества.
(Масса воды или растворов находится как произведение объема жидкocти на ее плотность, т.е. m=ρ·V. Плотность воды ρ равна 1 г/мл, плотность разбавленных растворов считать равной также 1 г/мл).
Пересчет теплового эффекта на 1 моль вещества, т.е. нахождение величины ∆H, производится по формуле
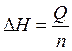
, (11)
где n – число молей вещества.
Все работы по определению изменения энтальпии химических процессов необходимо проводить в следующей последовательности.
1. Поместить в реакционный сосуд измеренный мензуркой объем воды или раствора и дождаться выравнивания температуры калориметра и окружающей среды. Для этого, выждав 3–5 мин, записывать показания термометра в течение трех минут с интервалом в 1 мин. Если температура практически не меняется, принятьее за величину tн.
2. Быстро внести через сухую воронку взвешенное на весах илиизмеренное цилиндром количество реагирующего вещества и, непрерывно перемешивая раствор мешалкой, производить замеры температуры через 0,5–
1 мин.
Результаты наблюдений записывать в видетаблицы:
| Время от начала опыта, мин | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 5,0 | 6,0 | |
| Температура, °С |
3. Построить график изменения температуры во времени на миллиметровой бумаге, отложив на оси ординат температуру, а на оси абсцисс – время в минутах. На рис.4 приведен примерный вид этого графика.
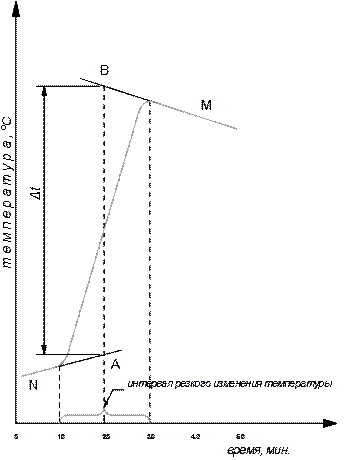 4. С помощью полученного графика найти изменение температуры в ходе опыта, ∆t = tк – tн. Для этого произвести экстраполяцию плавного линейного хода температуры конечного и исходного периодов времени (если температура в начале опыта не менялась, то прямая этого участка зависимости будет параллельна оси абсцисс).
4. С помощью полученного графика найти изменение температуры в ходе опыта, ∆t = tк – tн. Для этого произвести экстраполяцию плавного линейного хода температуры конечного и исходного периодов времени (если температура в начале опыта не менялась, то прямая этого участка зависимости будет параллельна оси абсцисс).
Отрезок времени, за который наблюдалось резкое изменение температуры, разделить пополам, из полученной точки восстановить перпендикуляр до пересечения с экстраполированными прямыми BM и NA.
Величина отрезка перпендикуляра АВ, отсекаемого этими прямыми, соответствует изменению температуры
∆t = tк – tн.
Рис. 4. Зависимость температуры
от времени
Используя описанные выше рекомендации, произведите измерение изменения температуры и вычислите значение энтальпии для некоторых процессов.
8. ЛАБОРАТОРНЫЕ РАБОТЫ
8.1. Определение энтальпии реакции нейтрализации
Реакции между растворами сильных кислот и сильных оснований, например:
NaOH + HCl→ NaCl+H2O,
KOH + ½ H2SO4→½ K2SO4 + H2O,
выражаются общим для них термохимическим уравнением
H+ + OH–→ H2O; .∆H= – 56,9 кДж/моль.
Теплота реакций нейтрализации слабых электролитов меньше 56,9Дж/моль. Значение теплоты реакции нейтрализации в этих случаях не является постоянным, т.к. оно зависит отприроды слабой кислоты и слабого основания. Это объясняется тем, что экзотермическому процессу образования воды из ионов H+ и OH– в случае взаимодействия слабых электролитов предшествует эндотермический процесс диссоциации электролитов (кислот и оснований). Чемменьшеколичество тепла, выделяющееся в результате реакции нейтрализации слабого электролита, тем больше энергии поглощается при его диссоциации, тем слабее электролит. Таким образом, силу электролита можносопоставить, сравнивая величину
∆Hнейтр. сл.эл–та – (–56,9) = .∆Hдисс. сл.эл–та
Чем больше эта величина, тем слабее электролит.
Выполнение работы
1. Получить у лаборанта растворы необходимых веществ:
а) NaOH и HCl;
б) NH4OH и HCl;
в) NaOH и CH3COOH;
г) NH4OH и CH3COOH;
д) KOH и HNO3.
2. Налить во внутренний стакан калориметра 40 мл раствора электролита с меньшей концентрацией (0,3–0,5 – молярный раствор). Измерить начальную температуру раствора (при работающей мешалке).
3. Быстро влить через воронку 10 мл электролита с большей концентрацией (1–2 –молярный раствор). Произвести измерение по методике, описанной в общих указаниях (гл. 7).
4. Рассчитать тепловые эффекты по формуле (10) и энтальпии реакции нейтрализации по формуле (11):
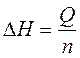 , где n – число молей электролита, взятого в недостатке.
, где n – число молей электролита, взятого в недостатке.
5. Оформить результаты работы и расчетов в виде следующей таблицы:
| Система | V, мл | СМ, моль/л |  
| ∆t, оС | Q, кДж | ∆H, кДж/моль |
| Кислота | ||||||
| Основание |
6. Сделать вывод по результатам работы.
7. Составить молекулярные и сокращенные уравнения реакций взаимодействия указанных электролитов.
8.2. Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)
Энтальпию реакции присоединения кристаллизационной воды к безводной соли можно определить, зная изменение энтальпии при растворении безводной солии изменение энтальпии при растворении кристаллогидрата этой соли.
В термохимии под энтальпией растворения понимают изменение энтальпии процесса растворения 1 моля вещества в большом количестве растворителя, т.е. в таком его количестве, когда дальнейшее разбавление раствора не влияет на величину энтальпии растворения (это так называемая дифференциальная энтальпия растворения). Энтальпия растворения веществ состоит в основном из двух слагаемых: энтальпии процесса перехода твердого или газообразного вещества в то состояние, в котором оно существует в растворе ∆Hр, и энтальпии процесса взаимодействия вещества с растворителем (энтальпия сольватации) ∆Hс. В зависимости от величины и знака этих двух слагаемых процесс растворения может быть эндотермическим или экзотермическим.
Для газов ∆Hр < 0 и величина ∆Hр представляет собой энтальпию конденсации при изменении объема газа до объема жидкого раствора.
У твердых веществ ∆Hр > 0, т.к. при их растворении затрачивается энергия на разрушение кристаллической решетки.
Таким образом, процесс растворения соли может быть представлен в виде двух этапов: разрушение кристаллической решетки соли с образованием раствора ее и взаимодействия частиц соли с растворителем. Процесс же растворения кристаллогидрата соли состоит только из разрушения кристаллической решетки, т.к. взаимодействия частиц кристаллогидрата с растворителем, можно считать, не происходит (молекулы соли уже связаны с молекулами растворителя).
Следовательно, энтальпия растворения безводной соли и ее кристаллогидрата отличается на величину энтальпии гидратации ∆Hгидр.
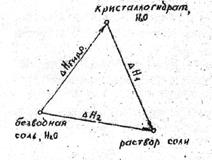
По закону Гесса:
∆Hгидр. + ∆H1 = ∆H2, (12)
где ∆Hгидр – изменение энтальпии в процессе образования кристаллогидрата, энтальпия гидратации или сольватации.
∆H1 – изменение энтальпии при растворении кристаллогидрата, энтальпия растворения кристаллогидрата;
∆H2 – изменение энтальпии при образовании раствора соли, энтальпия растворения соли.
Из уравнения (12) следует, что
∆Hгидр. = ∆H2 – ∆H1, (13)
где ∆H1; ∆H2 – величины, определяемые на основании экспериментальных данных.
Определив значения ∆H1 и ∆H2, рассчитайте значение ∆Hгидр. по уравнению (13) и, сравнивая полученную величину с табличными значениями энтальпий гидратации различных солей, установите, какая соль была выдана для исследования.
| Формула кристаллогидрата | ∆Hгидр., кДж/моль (∆Hс) |
| Na2CO3∙10H2O | –91 |
| ZnSO4∙7H2O | –95 |
| Na2SO4∙10H2O | –82 |
| Na2HPO4∙12H2O | –111 |
| SrCl2∙6H2O | –73 |
Найдя отклонение подученной опытной величины ∆Hгидр. от ее табличного значения, рассчитайте относительную ошибку в определении этой величины:
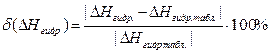
Выполнение работы
1. Получить у лаборанта навески безводной соли и ее кристаллогидрата с указанием числа молей и массы того и другого вещества (около 7 г, взвешенного с точностью до 0,01 г).
2. Налить во внутренний стакан калориметра мерным цилиндром 200 мл дистиллированной воды. Отметить начальную температуру (при работающей мешалке).
3. Быстро всыпать безводную соль в калориметрический стакан, измерение температуры осуществлять по методике, описанной в общих указаниях (гл. 7). Повторить аналогичный эксперимент c кристаллогидратом этой соли.
4. Рассчитать тепловые эффекты по формуле (10) и энтальпии процессов растворения соли и ее кристаллогидрата по формуле (11).
5. Рассчитать энтальпию гидратации соли и относительную ошибку этой величины.
6. Оформить результаты работы и расчетов в виде следующей таблицы.
| Число молей n | Масса вещества m | m + m(н2о), г | ∆t, ◦C | Q, кДж/моль | ∆H, кДж/моль | ∆Hгидр и δ(Hгидр) | |
| Безводная соль | |||||||
| Кристаллогидрат | |||||||
8.3. Определение энтальпии гидролиза карбонатов щелочных металлов
Процесс гидролиза растворимых карбонатов представляется в виде следующего уравнения:
CO32– + H2O ↔ HCO3– + OH–. 
Изменение энтальпии этого процесса ∆Нгидролиза связано с некоторыми трудностями, обусловленными в основном небольшой степенью гидролиза карбонатов, тогда как определение энтальпии обратного процесса – нейтрализации кислой соли – легко осуществимо.
Определив тепловой эффект этого процесса, Q можно рассчитать искомую величину ∆Нгидролиза:
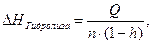

(14)
где 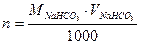 ; n – число молей соли, взятой для
; n – число молей соли, взятой для
нейтрализации
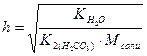 ; h – степень гидролиза;
; h – степень гидролиза;
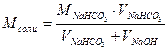 ; K2
; K2 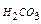 =4.7∙10-11– константа диссоциации угольной кислоты по второй ступени;
=4.7∙10-11– константа диссоциации угольной кислоты по второй ступени;
M 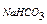 – молярная концентрация исходного раствора кислой соли, моль/л;
– молярная концентрация исходного раствора кислой соли, моль/л;
V 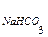 и V NaOH – объемы растворов кислой соли и щёлочи соответственно, вятые для исследования, мл.
и V NaOH – объемы растворов кислой соли и щёлочи соответственно, вятые для исследования, мл.
Выполнение работы
1. Влить во внутренний стакан калориметра 150 мл 0,5-молярного раствора NаНСO3 и отметить начальную температуру (при работающей мешалке).
2. Через воронку быстро влить туда же 150 мл 0,5-молярного раствора NaOH. Произвести измерение изменения температуры по методике, описанной в общих указаниях (гл. 7). (Вести отсчет времени от начала вливания раствора щелочи).
3. Записать результаты наблюдений в таблицу и произвести расчеты искомой величины.
V 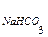 ,мл ,мл
| VNaOH,мл | Мсоли, моль/л | h | ∆t, оС | Q, кДж | n | ∆Нгидролиза, кДж/моль |
4. Какой знак имеет энтальпия процесса гидролиза? Дайте объяснение.
8.4.Определение энтальпии образования соли
Энтальпию образования соли MgSO4 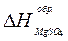 можно вычислить, используя следующие термохимические уравнения:
можно вычислить, используя следующие термохимические уравнения:
Mg(к) + Н2SO4(ратвор) → MgSO4(раствор)+ Н2(г); ΔН1
Н2(г) + S(к) + 2O2(г) +aq → Н2SO4(ратвор); ΔН2
MgSO4(раствор) → MgSO4(к)+ aq; ΔН3
Складывая эти уравнения, получают
Mg(к) + S(к) + 2O2(г) → MgSO4(к);
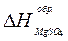 = ΔН1 + ΔН2 + ΔН3.
= ΔН1 + ΔН2 + ΔН3.
Энтальпию растворения магния в серной кислоте ΔН1, и его безводного сульфата в воде –ΔН3 определяют экспериментально, а энтальпия образования 0,5 н раствора H2SO4 ΔН2, по справочным данным, равна –894 кДж/моль.
Выполнение работы
1. Поместить во внутренний стакан калориметра 200 мл 0,5 н. раствора серной кислоты и отметить начальную температуру при работающей мешалке.
2. Опустить через воронку туда же точно взвешенное количество магния (около 0,2 г). Зафиксировать изменение температуры по методике, описанной в общих указаниях (гл. 7).
3. Вычислить ΔН1, используя формулы (11) и (12),где

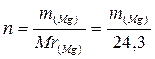 , а m(Mg) – навеска магния, г.
, а m(Mg) – навеска магния, г.
4. Таким же способом определить (–ΔН3), растворяя точную навеску MgSO4 (около 2 г) в 200 мл воды.
5. Вычислить ΔН3, используя формулы (6) и (7),
где 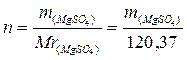 ,
,
m 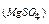 – навеска MgSO4, г.
– навеска MgSO4, г.
6. Вычислить 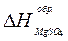 и сравнить ее с табличным значением, равным –1280 кДж/моль.
и сравнить ее с табличным значением, равным –1280 кДж/моль.
Определить относительную ошибку вычисленной величины:
 .
.
9. ВЫЧИСЛЕНИЯ ЭНЕРГИИ СВЯЗИ ПО ТЕПЛОВОМУ ЭФФЕКТУ
И НАОБОРОТ
Значениями энергии связи часто пользуются для вычисления тепловых эффектов реакций, если неизвестны ΔНобр соединений, участвующих в реакциях. С другой стороны, значения теплот образования, возгонки, диссоциации и других энергетических эффектов используются для определения прочности межатомных и межмолекулярных связей. Расчеты эти не очень точны, т.к. на величину энергии химической связи между двумя атомами оказывают влияние другие, входящие в молекулу атомы. Поэтому энергия химической связи между какими-либо конкретными атомами, входящими в состав различных молекул, не совсем одинакова.
Энергия связи или энтальпия связи – это энтальпия процесса образования ковалентной связи между двумя атомами, взятыми в газообразном состоянии. Например:
Н(г) + CI(г) → HCI(г); ΔН(H–CI) = –431,4 кДж
Не путать энтальпию связи с энтальпией образования:
½ Н2(г) + ½ CI2(г) → HCI(г); ΔНобр.(HCI) = –92,3 кДж.
Значения энтальпий различных связей приведены в табл. 3 приложения.
Рассмотрим следующие, примеры вычислений.
Пример 1
Считая связь N–N в молекуле гидразина одинарной, а среднюю энергию связи N–Н в аммиаке и гидразине одинаковой и пользуясь табличными значениями энергий связи Н–Н, вычислить изменение энтальпии реакции
2NH3(г) → N2H4(г) + Н2(г)
Решение. Представим уравнение реакции в следующем виде:
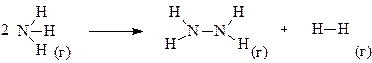
На разрыв связей в исходных веществах энергия затрачивается, а при образовании связей в продуктах реакции она выделяется, поэтому, подсчитывая число определенных связей в продуктах реакции и исходном веществе, можно записать:
ΔНреакции = – (ΔНN–N + 4ΔНN–H + ΔНH–H) + 6ΔНN–H =2ΔНN–H – ΔНN–N – ΔНH–H =
= 2·390,6 – 113,4 – 436 = 231,8 кДж
Процесс является эндотермическим, так как на разрыв связей в исходном веществе затрачивается больше энергии, чем ее выделяется при образовании связей в продуктах реакции.
Пример 2
Рассчитать энтальпии связей С–H и С–С, используя следующие данные:
C(графит) + 2H2(г) → СH4(г); ΔН1 = –74,85 кДж
2C(графит) + 3H2(г) → С2H6(г); ΔН2 = –84,67 кДж
C(графит) → С(г); ΔН3 = 724 кДж
H2(г) → 2Н(г); ΔН4 = 435,9 кДж
Решение:
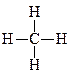
→ C(г) + 4H(г); ΔH5 = –4 ΔHC–H
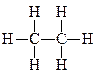
→ 2C(г) + 6H(г); ΔH6 = –(ΔHC–C + 6 ΔHС–H)
Такие термохимические уравнения можно получить из исходных. Умножим четвертое уравнение на 2 и вычтем из первого уравнения, а результат вычтем еще из третьего уравнения, получим следующее термохимическое уравнение:
СН4(г) → С(г) + 4Н(г);
ΔН5 = ΔН3 – (ΔН1 – 2ΔН4) = 1670,65 кДж.
Из второго уравнения вычтем удвоенное третье уравнение и из полученной разности вычтем утроенное четвертое уравнение:
С2Н6(г) → 2С(г) + 6Н(г);
ΔН6 = – (ΔН2 – 2ΔН3 –3ΔН4) = 2843,7 кДж
ΔН5 = – 4ΔНС–Н = 1670,65 кДж;
ΔН6 = – (ΔНС–С + 6ΔНС–Н) = 2671 кДж
Решая систему уравнений, находим ΔНС–Н = –419 кДж/моль,
ΔНС–С = –330 кДж/моль.
10. КОНТРОЛЬНЫЕ ВОПРОСЫ
Для проверки степени усвоения материала рекомендуется ответить на следующие контрольные вопросы.
1. Сформулировать первый закон термодинамики.
2. Что называется системой в термодинамике?
3. Объяснить следующие понятия:
– теплота;
– работа;
– закрытая система;
– изолированная система;
– внутренняя энергия.
4. Какие свойства системы называются параметрами состояния?
5. Какие свойства системы называются функциями состояния?
6. Какие уравнения называются термохимическими?
7. Какие условия приняты за стандартные?
8. Что называется теплотой образования вещества?
9. Что называется теплотой сгорания вещества?
10. Чему равен тепловой эффект реакции при постоянном объёме?
11. Чему равен тепловой эффект реакции при постоянном давлении?
12. Что такое энтальпия?
13. Каков знак величины ΔН в эндо– и экзотермическом процессе?
14. Какой особенностью характеризуются термодинамические функции состояния?
15. Как формулируется закон Гесса?
16. Какие следствия вытекают из закона Гесса?
17. Что такое энтропия?
18. Сформулировать второй закон термодинамики.
19. Что называется термодинамической вероятностью состояния системы?
20. Сформулировать третий закон термодинамики.
21. Почему энтропия вещества является абсолютной величиной, а энтальпия образования его – разностной?
22. Что такое изобарно–изотермический потенциал или энергия Гиббса?
23. Почему изобарно–изотермический потенциал может рассматриваться как критерий при оценке направления самопроизвольно протекающей химической реакции?
24. Что такое энтальпия нейтрализации? Почему энтальпия нейтрализации сильных кислот и оснований одинакова для различных кислот и оснований, а энтальпия нейтрализации слабых кислот и оснований зависит от природы реагирующих веществ?
25.Каково соотношение между величинами теплоты нейтрализации сильных кислот сильными основаниями и теплоты диссоциации воды?
26. Что такое теплота растворения?
27. Что называют теплотой или энтальпией гидратации?
28. Что такое энтальпия гидролиза? Почему ее сложно измерить? Какой она имеет знак?
29. Что такое энтальпия связи? Почему величина энтальпии реакции, вычисленная по энергиям химических связей реагентов, является приближенной?
30. Предскажите знак изменения энтальпии системы в каждом из следующих процессов, исходя из предположения о возможности теплового обмена между системой и окружающей средой:
30.1. H2O(ж) → H2O(г)
30.2. 2CH3 (г) + 3O2 (г) →2 СО2 (г) + H2O(ж)
30.3. 2HCl(г) + → H2 (г) + Cl2 (г)
30.4. NH4Cl(к) + H2O(ж) → NH4Cl(раствор)(температура понижается)
30.5. O(г) + 2H(г) → H2O(г)
30.6. Ba2+(р) + SO42–(р) → BaSO4 (к)
30.7. 2Na (к) + Cl2 (г) → 2NaCl(к)
31. Не проводя расчета, определите, для каких из приведенных реакций
разница в значениях Qpи Qv будет наибольшей:
31.1. С(к) + 1/2O2 (г) → СО (г)
31.2. С(к) + O2 (г) → СО2 (г)
31.3. 2С(к) + 3Н2 (г) → C2H6 (г)
32. Какие из перечисленных веществ можно отнести к числу стабильных?
[ 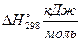 ] ]
| H2O(г) | H2Se(г) | Al2O3 (к) | N2O3 (г) | SiO2 (к) | ClO2 (г) | SF6 (г) |
| –242 | +30 | –1675 | +83 | –912 | +104 | – 1221 |
33. Как изменяется энтропия при обратимом фазовом переходе:
твердое вещество → жидкое → газ → твердое вещество?
34. Как объяснить изменение величин энтропии в приведенных рядах сходных веществ?
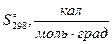 
| |||||
| NO(г) | 50,34 | О(г) | 38,47 | S(т) | 7,62 |
| NO2 (г) | 54,47 | О2 (г) | 49,01 | Se(т) | 10,50 |
| N2O5 (г) | 82,00 | О3 (г) | 57,10 | Te(т) | 11,85 |
35. Не проводя расчетов, определить знак ΔS в ходе химических реакций
2Р(к) + 5/2О2 (г) → Р2О5 (к)
(NH4)2Cr2O7 (к) → N2 (г)+ Cr2O3 (к) + 4Н2О(г)
36. Для некоторой реакции
2А2 (г) + В2 (г) → 2А2В(г)
∆S < 0. Значит ли это, что реакция термодинамически невозможна?
37. Для реакции Н2 (г) + F2 (г) → 2HF(г)
в стандартных условиях изменение энтропии равно –269,6 кДж/моль град.
Вычислить изменение стандартного изобарно–изотермического потенциала этой реакции.
38. Какую информацию о веществе можно получить, используя величину изобарно–изотермического потенциала его образования?
39. Расположить перечисленные вещества в порядке увеличения их термической устойчивости, с учетом приведенных значений:
СаF2 (к) СаС2 (к) СаО (к) СаN2 (к)
Δ G о298 ккал/моль –278 –16 –144 –88
Как это объяснить?
40. Чем объяснить, что из двух реакций, термодинамически не возможных в стандартных условиях:
N2 (г) + 1/2О2 (г) → N2O(г); ΔНо1 = 19,5 ккал/моль
1/2N2 (г) + 1/2О2 (г) → NO(г); ΔНо2 = 21,6 ккал/моль
только одна из них становится возможной при высокой температуре?
41. Почему при температурах, мало отличающихся от 0 К, стремление к минимуму энергии может рассматриваться как единственный принцип, определяющий направление химического процесса?
42. В каких термодинамических условиях термодинамически возможны экзотермические реакции; эндотермические реакции?
43. Почему даже наиболее термодинамически стабильные вещества при достаточно высокой температуре разлагаются?
44. Можно ли, изменяя температуру, изменить направление следующих реакций:
44.1. 2NО(г) + О2 (г) → NO2 (г); ΔНо = –27,02 ккал
44.2. N2О4 (г) → 2NO2 (г); ΔНо = –13,88 ккал
44.3. 2SО2 (г) + О2 (г) → 2SO3 (г); ΔНо = –46,95 ккал
44.4. PCI5 (г) → PCI3(г) + СI2 (г); ΔНо = 44 ккал
44.5. СО2 (г) + С(графит) → 2СО(г); ΔНо = 38,3 ккал?
45. Исходя из знака Δ G о298 следующих реакций
PbO2 (к) + Pb (к) = 2PbO (к), Δ G о298 < 0;
SnO2 (к) + Sn (к) = 2SnO (к), Δ G о298 > 0,
сделать вывод о том, какие степени окисления более характерны для свинца и олова.
46 Учитывая, что NO2 (г) окрашен, N2O4 (г) бесцветен, и исходя из знака изменения энтропии в реакции 2NO2 (г) = N2O4 (г), предсказать, как изменится окраска в системе NO2 (г) – N2O4 (г) с ростом температуры: усилится или ослабнет.
11.ТЕСТОВЫЕ ЗАДАНИЯ ДЛЯ САМОПРОВЕРКИ ПО ТЕМЕ:
ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
1. Энергией называется:
а) физическая величина, характеризующая направление теплообмена между системами;
б) экзотермический химический процесс;
в) физическая величина, являющаяся мерой взаимодействия и движения материальных систем;
г) термодинамическое состояние системы.
2. При рассмотрении химической реакции понятие система означает:
а) исходные реагенты;
б) продукты химической реакции;
в) реакционный сосуд;
г) исходные реагенты и продукты реакции.
3. В зависимости от способности химической системы к обмену энергией и веществом с окружающей средой различают три типа систем: изолированные, закрытые и открытые. Окружающей средой называют:
а) выделенную (реально или условно) часть материального мира, которая является предметом наблюдения или исследования;
б) атмосферу Земли;
в) всю остальную часть материального мира вне пределов выделенной из него системы;
г) стенки реакционного сосуда.
4. Изолированная система с окружающей ее средой:
а) обменивается энергией, но не обменивается веществом;
б) не обменивается ни веществом, ни энергией;
в) обменивается веществом, но не обменивается энергией;
г) обменивается и энергией, и веществом.
5. Химическая реакция обязательно сопровождается выделением или поглощением энергии, поскольку:
а) ее протекание заключается в разрыве одних и образовании других химических связей;
б) ее протекание требует столкновения реагирующих частиц;
в) для ее протекания необходима энергия, равная энергии активации;
г) при ее протекании не затрагиваются ядра атомов;
6. Первый закон (первое начало) термодинамики математически записывается так:
а) pV=vRT;
б) k=R/NA;
в) k = Aexp(–Ea/RT);
г) ΔU=Q–А.
7. Сформулируйте первый закон термодинамики:
а) скорость химической реакции определяется энергией активации данной реакции;
б) физические величины, однозначно определяющие состояние системы, являются функциями состояния системы;
в) сумма изменения внутренней энергии и совершенной системой (или над системой) работы равна сообщенной (или выделенной ею) теплоте;
г) при одинаковых условиях в равных объемах различных газов содержится одинаковое число молекул.
8. В каких единицах выражаются величины, входящие в математическое соотношение первого начала термодинамики?
а) в единицах заряда, например в кулонах
б) в единицах давления, например в паскалях
в) в единицах энергии, например в джоулях
г) в единицах времени, например в секундах
9. Тепловой эффект химической реакции при постоянном давлении — это...
а) количество выделившейся или поглощенной теплоты в результате взаимодействия между собой строго определенных количеств веществ;
б) изменение внутренней энергии в результате химической реакции;
в) изменение энтальпии в результате химической реакции;
г) работа, выполненная в ходе химической реакции.
10. В экзотермической реакции...
а) энтальпия реакционной системы повышается (ΔH > 0);
б) тепловой эффект реакции отрицательный (Qр < 0);
в) энтальпия реакционной системы уменьшается ( ΔH < 0);
г) давление реакционной системы повышается.
11. В эндотермической реакции...
а) энтальпия реакционной системы увеличивается (ΔH > 0);
б) тепловой эффект реакции положителен (Qр > 0);
в) энтальпия реакционной системы уменьшается (ΔH < 0);
г) резко замедляется скорость химической реакции.
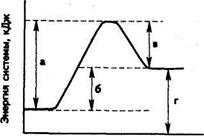
12. Какой из отрезков на диаграмме соответствует тепловому эффекту реакции?
Date: 2015-09-18; view: 4360; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |