
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплотой сгорания вещества называют тепловой эффект реакции окисления в кислороде (O2) 1 моль вещества с образованием оксидов, устойчивых в стандартных условиях
Например, тепловой эффект реакции
С2Н6 (г) + 7/2O2 (г)=2СО2 (г) + 3Н2О(ж), равный –1559,88 кДж/моль, является теплотой сгорания этана.
Значения теплоты образования и сгорания различных веществ используются для осуществления различных термохимических вычислений.
Для химических реакций под работой в основном подразумевается действие против внешнего давления. Она связана с изменением объёма. Например, при выделении газа в ходе реакции (рис 1.) Работа против внешнего давления равна произведению давления p на изменение объема системы Δ V при переходе её из состояния 1 в состояние 2:
А = р(V2 – V1) = р Δ V.
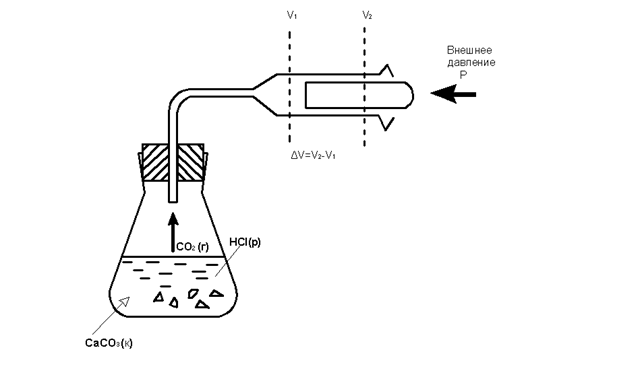 Рис. 1. Работа, выполняемая химической системой против внешнего давления р (поршень невесомый)
Рис. 1. Работа, выполняемая химической системой против внешнего давления р (поршень невесомый)
При изохорном процессе (V =const), Δ V =0 и А= p Δ V =0. Тогда, обозначив символом Q v тепловой эффект, согласно первому закону термодинамики (1) можно записать:
Q v = Δ U, (2)
т.е. тепловой эффект химической реакции при постоянном объёме равен изменению внутренней энергии.
Химические реакции чаще проводят в открытых сосудах, т.е. при практически постоянном атмосферном давлении (p= const). В этом случае, обозначив тепловой эффект реакции Q p, имеем
Q Р = Δ U + p Δ V
Полученное выражение можно упростить, если воспользоваться термодинамической функцией, которая называется энтальпией. Энтальпию обозначают буквой Н и определяют как Н = U + pV.
Энтальпию можно рассматривать как энергию расширенной системы. Таким образом,
Qp = ∆U + р∆V = U2 –U1+р∙(V2 –V1) = (U2+ рV2) – (U1+ рV1) = H2 – H1 = ∆H
Q Р = Δ Н, (3)
т.е. тепловой эффект реакции при постоянном давлении равен изменению энтальпии.
Отметим, что реакции, в которых исходные вещества и продукты находятся в жидком или твердом состоянии, протекают без существенных изменений объёма. В химической термодинамике объёмами конденсированных фаз пренебрегают. Например, 1 моль жидкой воды занимает объём 18 мл – 18 10–3 л, а в парообразном состоянии 22,4 л. Поэтому для конденсированных веществ Δ V ≈0 и p Δ V ≈0, а Δ Н ≈Δ U. Если в реакции участвуют газы, то изменение объёма может быть значительным, и в этом случае Δ Н иΔ U сильно отличаются. Произведение pV для n молей газа будет равно nRT. Если в реакции расходуется n 1молей газообразных веществ и образуется n 2 молей газообразных продуктов,то р Δ V =(n 2– n 1) RT= Δ nRT. Следовательно,
Q p = Δ Н = Δ U + Δ nRT = Q v + Δ nRT (4)
3. ЗАКОН ГЕССА И СЛЕДСТВИЯ ИЗ НЕГО
Важнейшим свойством любой функции состояния является независимость ее изменения от способа, или пути, изменения состояния системы. Из полученных уравнений (2) и (3) вытекает заключение, называемое законом Гесса. Тепловой эффект химических реакций, протекающих при постоянном давлении или объеме, не зависит от пути протекания реакции и определяется состоянием исходных веществ и продуктов реакции.
Этот вывод былсделан русским химиком Гессом в 1840 г. на основании эмпирических данных и лежит в основе термохимических вычислений. Следствиями из закона Гесса являются следующие положения.
Date: 2015-09-18; view: 660; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |