
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тепловой эффект обратного процесса равен по величине тепловому эффекту прямого процесса, но с противоположным знаком
∆ H пр.= –∆ H обратн.
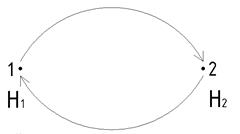
∆ H пр. = H 2– H 1
 ∆ H обрат. = H 1– H 2= –∆ H пр.
∆ H обрат. = H 1– H 2= –∆ H пр.
Тепловой эффект кругового процесса равен нулю.
∆ H круг. = ∆ H пр. + ∆ H обрат. = ∆ H пр. – ∆ H пр. = 0
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. При суммировании необходимо учитывать количество молей соответствующих веществ.
В общем виде тепловой эффект ∆ H ºр реакции
а А + b В → с С + d D
равен:
∆ H ºp = [c ∆ H ºобр.(С) + d ∆ H ºобр.(D)] – [a ∆ H ºобр.(A) + b ∆ H ºобр.(B)]
или
∆ H ºp = Σ∆ H ºобр.(прод.) – Σ∆ H ºобр.(исх.)
Например, для реакции
C6H12O6 (тв)+6 O2 (г) → 6 H2O(ж) + 6 СO2 (г)
∆ H р = 6 ∆ H обр(H2O(ж) + 6 ∆ H обр(СO2 (г)) – ∆ H обр(С6Н12O6 (тв))
Δ H обр.(О2)=0, т.к. энтальпии образования простых веществ приняты равными нулю.
Пользуясь следствием закона Гесса, можно вычислить изменение энтальпии любых реакций, исходя из значений энтальпий образования исходных веществ и продуктов. В табл. 1 приложения приведены значения изменений энтальпий образования некоторых веществ в стандартных условиях (стандартных теплот образования), ΔHº298. Используя данные табл.1, можем рассчитать Δ H р.для рассматриваемого процесса:
Δ H р. = 6 (–285,8) +6 (–393,5) – (–1273,0) = –2802,8 кДж
Величина и знак стандартных энтальпий образования веществ являются важными количественными характеристиками веществ, особенно при сравнительной оценке однотипных соединений. В целом можно утверждать: чем более отрицательное значение имеет стандартная энтальпия образования вещества, тем устойчивее вещество.
Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции. При суммировании необходимо учитывать количество молей соответствующих веществ.
∆ H ºp = Σ∆ H ºсгор.(исх.) – Σ∆ H ºсгор.(прод.)
В табл. 2 приложения приведены значения энтальпий сгорания некоторых веществ в стандартных условиях (стандартных теплот сгорания).
Например, тепловой эффект реакции
C2H4 (г) + H2 (г) → C2H6 (г)
может быть определен через теплоты сгорания исходных веществ и продуктов реакции следующим образом:
Δ H ºр. = Δ H ºсгор.(C2H4 (г)) + Δ H ºсгор.(H2 (г)) – Δ H ºсгор.(C2H6 (г)) = –1410,97 +
(–285,84) – (–1559,88)= –136,93 кДж.
С термохимическими уравнениями можно совершать алгебраические действия, их можно умножать и делить на постоянное число, складывать одно уравнение с другим и вычитать одно из другого, переносить члены уравнения из одной части уравнения в другую, изменяя при этом знак.
Подобные алгебраические действия с термохимическими уравнениями позволяют определять тепловые эффекты таких реакций, которые трудно осуществить на практике. Например:
С + O2 = CO2; Δ H º1= –393,5 кДж/моль
СO + ½ O2 = CO2; Δ H º2= –283,0 кДж/моль
С + ½O2 = CO; Δ H ºx-?
Для нахождения ΔHºx вычтем из первого термохимического уравнения второе:
С + O2 – СO – ½ O2 = CO2 – CO2;
С + ½ O2 = CO; Δ H º1 – Δ H º2
При сопоставлении полученного уравнения с искомым убеждаемся, что они идентичны, следовательно,
Δ H ºx = Δ H º1 – Δ H º2 = –393,5 + 283,0 = – 110,5 кДж/моль.
4. ЭНТРОПИЯ. ВТОРОЙ И ТРЕТИЙ ЗАКОНЫ ТЕРМОДИНАМИКИ
Date: 2015-09-18; view: 585; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |