
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электрон в первую очередь располагается в пределах электронной подоболочки с наинизшей энергией
Очередность подоболочек по энергии определяется с помощью правила Клечковского. Поясним это.
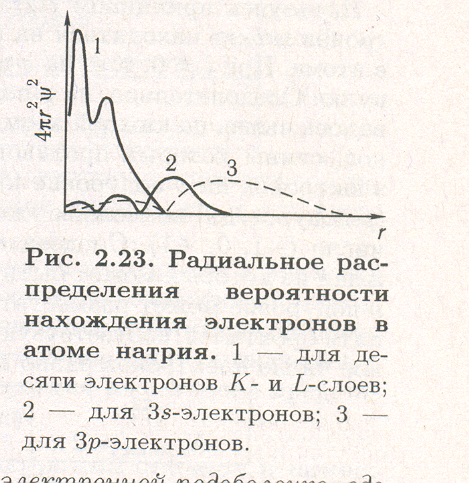
Каждая АО имеет на кривой радиального распределения вероятности нахождения электрона в элементе пространства (говорят — электронной плотности) определенное число максимумов. Всегда присутствует основной максимум. Общее число максимумов в радиальном распределении электронной плотности для конкретной орбитали может быть найдено через ее значения главного и орбитального квантовых чисел:
число максимумов электронной плотности АО = n-l.
Электронная плотность, которая относится к максимумам, расположенным ближе к ядру, испытывает меньшее экранирующее действие других электронов, и электрон, находясь в этой области пространства, сильнее притягивается к ядру. Поэтому при прочих равных условиях, чем больше максимумов электронной плотности у АО, тем более низкую энергию имеет электрон, описываемый ею. Как показывает рис. 2.23, электронное облако Зs-электрона в большей степени (3—0 = 3 максимума электронной плотности) проникает в область, занятую электронами К- и L -слоев, и потому экранируется слабее, чем электронное облако Зр-электрона (3 — 1 =2 максимума). Следовательно, электрон в состоянии 3s будет сильнее притягиваться к ядру и обладать меньшей энергией, чем электрон в состоянии Зр. Электронное облако Зd-орбитали практически полностью находится вне области, занятой внутренними электронами, экранируется в наибольшей степени и наиболее слабо притягивается к ядру. Именно поэтому устойчивое состояние атома натрия соответствует размещению внешнего электрона на орбитали Зs.
Таким образом, в многоэлектронных атомах энергия электрона зависит не только от главного, но и от орбитального квантового числа. Главное квантовое число определяет здесь лишь некоторую энергетическую зону, в пределах которой точное значение энергии электрона определяется величиной l. При этом справедливо первое правило Клечковского:
электрон обладает наинизшей энергией на той электронной подоболочке, где сумма квантовых чисел n и l минимальна
Е = min при п + I = min.
В тех случаях, когда сумма (n +l) одинакова для рассматриваемых электронных подоболочек, при распределении электронов используется второе правило Клечковского:
электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа
Е = min при n = min, если п + I = const.
Принцип Паули. Данный принцип состоит в том, что
в атоме не может быть электронов, имеющих одинаковый набор всех четырех квантовых чисел.
Вспомним, что электрон может характеризоваться только одним набором 4-х квантовых чисел (n, l, mi и ms), а одной пространственной атомной орбитали (АО) соответствует состояние с фиксированными значениями 3-х квантовых чисел (n, l, mi ). Тогда по принципу Паули для конкретной АО возможно лишь столько состояний, электрона, сколько
различных значений возможно для четвертого квантового числа тs. Для последнего возможны лишь два значения. Поэтому максимальное количество электронов для одной АО — 2.
Пользуясь принципом Паули, подсчитаем, какое максимальное число электронов может находиться на различных энергетических подуровнях и уровнях в атоме. При l = 0, т. е. на s-подуровне, магнитное квантовое число тоже равно нулю. Следовательно, на s-подуровне имеется всего одна орбиталь. Как указывалось выше, на каждой атомной орбитали размещается не более двух электронов, спины которых противоположно направлены. Итак, максимальное число электронов на s-подуровне каждой электронной оболочки равно 2. При l = 1 (p-подуровень) возможны уже три различных значения магнитного квантового числа (— 1, 0, +1). Следовательно, на р-подуровне имеется три орбитали, каждая из которых может быть занята не более чем двумя электронами. Всего на р-подуровие может разместиться 6 электронов. Подуровень d ( l = 2) состоит из пяти орбиталей, соответствующих пяти разным значениям mi; здесь максимальное число электронов равно 10.
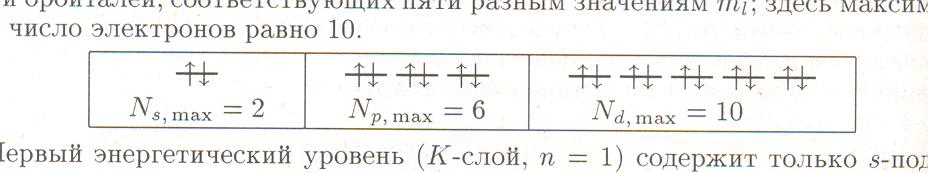
Первый энергетический уровень (K-слой, n = 1) содержит только s-подуровень, второй энергетический уровень (L-слой, n = 2) состоит из s- и p-подуровней и т. д. Учитывая это, составим таблицу максимального числа электронов, размещающихся на различных энергетических уровнях (в электронных оболочках) (табл. 2.4).

Максимальное количество электронов в оболочке можно получить суммированием числа электронов на подоболочках и оно равно 2n2
Правило Хунда. Это правило определяет порядок размещения электронов в пределах одной электронной подоболочки для наиболее устойчивого состояния атома. Оно гласит:
в наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален.
Например, на 2р-подоболочке 3 электрона могут разместиться различным образом: 
Но только в первом случае, когда каждой АО соответствует электрон со спином + 1/2, достигается максимальный суммарный спин. Значит, это и есть энергетически самое выгодное состояние системы.
Правило Хунда не запрещает другого распределения электронов в пределах электронной подоболочки. Состояния атома с меньшими, по сравнению с максимальным, значениями суммарного спина электронов будут энергетически менее выгодными и, в отличие от первого, называемого основным, будут относиться к возбужденным состояниям. В приведенном примере для атома азота представлены одно основное и два возбужденных состояния.
Date: 2015-09-18; view: 1069; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |