
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия Гиббса (изобарно-изотермический потенциал)
Для изучения открытых и закрытых систем в термодинамике используют так называемые термодинамические потенциалы, к числу которых относится изобарно-изотермический потенциал G. Понятие об этом потенциале было введено на основе объединенного уравнения первого и второго закона термодинамики.
В конечном итоге: 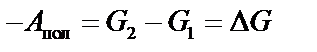 , или
, или 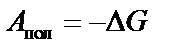 .
.
Величину G называют свободной энергией Гиббса, или изобарно-изотермическим потенциалом. Из выражения 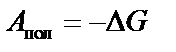 следует:
следует:
– если система самопроизвольно совершает работу (А > 0), то Δ G < 0, т.е. процесс самопроизвольный;
– если система не совершает работу, то А = 0 и Δ G = 0, т.е. система находится в состоянии термодинамического равновесия.
Энергия Гиббса − функция состояния, зависит только от начального и конечного состояний системы и определяет направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изобарно-изотермических условиях.
Направление и предел самопроизвольного протекания процесса в закрытых системах определяет принцип минимума свободной энергии:
Самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы. Система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
Для изобарно-изотермических условий (P = const, T = const):
1)если Δ G < 0, то возможен самопроизвольный процесс;
2)если Δ G = 0, то наступает состояние равновесия, реакция может протекать как в прямом, так и в обратном направлениях, т.е. реакция обратима;
3)если Δ G > 0, то процесс в прямом направлении невозможен, однако для обратного процесса будет выполняться соотношение
Δ G < 0.
Энтальпийный и энтропийный факторы. Выражение для свободной энергии Гиббса можно написать и в другом виде:
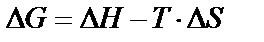 , (11)
, (11)
или
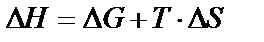 . (12)
. (12)
Значение Δ Н называется энтальпийным фактором, значение Т ∙ Δ S – энтропийным фактором. Как видно, энтальпия химической реакции включает в себя две части. Первая часть (первый член этого уравнения) Δ G равна максимальной работе W pmax, которую может совершить система при равновесном проведении процесса в изобарно-изотермических условиях.
Следовательно, энергия Гиббса – это часть энергетического эффекта химической реакции, которую можно превратить в работу:
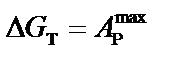 . (13)
. (13)
Поскольку энергию Гиббса можно превратить в работу, то ее также называют свободной энергией.
Второй член правой части уравнения (энтропийный фактор) представляет собой часть энергетического эффекта, которую невозможно превратить в работу.
Эта часть эффекта рассеивается в окружающую среду в виде теплоты. Поэтому энтропийный фактор T ∙ Δ S называют связанной энергией.
Энтальпийный фактор характеризует cтремление системы к минимуму полной энергии, энтропийный фактор характеризует стремление системы к максимуму беспорядка. Рассмотрим изменение свободной энергии Гиббса в зависимости от изменения этих двух факторов.
Первый случай. Пусть Δ Н < 0 (экзотермический процесс), а Т ∙ Δ S > 0. Тогда из формулы Δ G = Δ Н – Т ∙ Δ S видно, что Δ G < 0 и процесс протекает самопроизвольно.
Второй случай. Δ Н > 0 (эндотермический процесс), Т ∙ Δ S < 0, тогда Δ G > 0. В этом случае самопроизвольный процесс не протекает, но может протекать при затрате энергии из окружающей среды.
Третий случай. Δ Н = Т ∙ Δ S, тогда Δ G = 0. Наступает термодинамическое равновесие в системе.
Четвертый случай. Δ Н < 0 и Т ∙ Δ S < 0,Δ Н > 0 и Т ∙ Δ S > 0. В этом случае значение Δ G зависит от того, какая из величин больше: Δ Н или Т ∙ Δ S.
Если Т ∙ Δ S >>Δ Н, то Δ G < 0; если Т ∙ Δ S << Δ Н, то Δ G < 0.
Расчет Δ G в химических реакциях:
1) Изменение свободной энергии Гиббса для химической реакции может быть вычислено из стандартных значений Δ G ° продуктов реакции по формуле
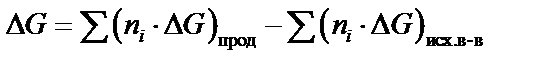 . (14)
. (14)
Значение свободной энергии Гиббса для простых веществ в стандартном состоянии принимается за нуль.
2) Если известны значения Δ Н° и Δ S°, то Δ G реакции рассчитывают по формуле:
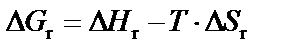 . (15)
. (15)
Значения Δ Н° реакции и Δ S° реакции рассчитывают предварительно по формулам (6) и (10):
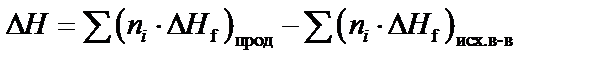 ,
,
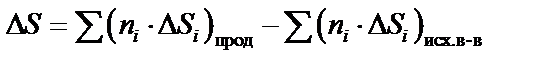 .
.
Энергия Гиббса зависит от характера реакции (значений Δ Н и Δ S), а для многих реакций и от температуры (таблица 1).
Для определения температуры, выше которой происходит смена знака энергии Гиббса реакции, можно воспользоваться условием:
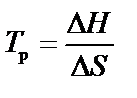 , (16)
, (16)
где Т р– температура, при которой устанавливается равновесие, т.е. равновероятная возможность протекания прямой и обратной реакций.
Таблица 1 – Влияние температуры на направление химических
реакций
| Δ Н | Δ S | Δ G | Направление реакции |
| Δ Н < 0 | Δ S > 0 | Δ G < 0 | Прямая реакция самопроизвольно протекает при любой температуре |
| Δ Н > 0 | Δ S < 0 | Δ G > 0 | Прямая реакция самопроизвольно не может протекать при любой температуре |
| Δ Н < 0 | Δ S < 0 | Δ G < 0 при Т < Т р Δ G > 0 при Т > Т р | Самопроизвольно может идти прямая реакция при низких температурах и обратная реакция – при высоких температурах |
| Δ Н > 0 | Δ S > 0 | Δ G > 0 при Т < Т р Δ G < 0 при Т > Т р | Самопроизвольно может протекать прямая реакция при высоких температурах и обратная реакция – при низких температурах |
Date: 2015-09-18; view: 1081; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |