
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретическая часть. Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение
Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить реакции горения топлива. Поэтому тепловые эффекты реакций уже давно тщательно изучаются. Существует особый раздел науки – химическая термодинамика.
Термодинамика – это наука о взаимных превращениях различных видов энергии друг в друга, а также о формах передачи энергии в виде теплоты и работы.
Химическая термодинамика – часть термодинамики, которая рассматривает превращения энергии и работы при химических реакциях.
Задачи химической термодинамики:
1) установление энергетических эффектов химических и физико-химических процессов (тепловые эффекты химических реакций);
2) установление возможности самопроизвольного протекания химических процессов;
3) установление условий равновесного состояния термодинамических процессов.
Основные понятия химической термодинамики
Термодинамическая система – это тело или совокупность тел, ограниченных от окружающей среды мысленно или реально существующими границами. Примерами системы могут быть различные объекты: газ в сосуде, раствор реагентов в колбе, кристалл вещества или даже мысленно выделенная часть этих объектов. Типы термодинамических систем:
1) изолированные системы – такие системы не обмениваются с окружающей средой ни веществом, ни энергией (в природе таких систем нет);
2) закрытые системы – эти системы обмениваются с окружающей средой энергией, но не веществом (например: электрическая лампочка, герметически закрытый сосуд с теплопроводящими стенками);
3) открытые системы – такие системы обмениваются с окружающей средой веществом и энергией (например: живые организмы).
По составу системы разделяются на гомогенные и гетерогенные.
Гомогенные системы однофазные, не имеют поверхности раздела. Все части системы имеют одинаковые химические и физические свойства. Например: воздух (смесь газов), истинные растворы.
Гетерогенные системы многофазные, неоднородные, имеют поверхность раздела. Например: лед в воде, жидкость и пар.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами. Например: система лед–вода. Одна фаза – лед, другая – вода.
Состояние системы, стандартное состояние. Состояние системы определяется совокупностью ее физических и химических свойств. Если свойства изменяются, то изменяется и состояние системы; если же свойства системы не изменяются со временем, то система находится в состоянии равновесия.
Для сравнения свойств термодинамических систем необходимо точно указать их состояние. С этой целью введено понятие стандартное состояние, за которое для индивидуальной жидкости или твердого тела принимается такое физическое состояние, в котором они наиболее устойчивы при давлении в 1 атм (101325 Па) и определенной постоянной температуре Т.
Температура может быть любой постоянной, но чаще всего это 298 К. Для твердых веществ наиболее устойчивым состоянием при давлении 101,325 кПа и температуре 298 К является кристаллическое, которое и принимается за стандартное. Для газов и паров стандартное состояние – это гипотетическое состояние, в котором газ при давлении в 101,325 кПа подчиняется законам идеальных газов при данной температуре.
Величины, которые относятся к стандартному состоянию, пишутся с индексом «о» вверху и температурой внизу. Например: Δ Н °298.
Термодинамические параметры состояния системы. Все величины, характеризующие то или иное макроскопическое состояние системы, называются термодинамическими параметрами. Различают независимые (основные) и зависимые термодинамические параметры. Независимые термодинамические параметры можно измерить (например температура, давление, масса, объем, плотность). Зависимые термодинамические параметры (функции состояния системы) нельзя измерить, так как они зависят от остальных параметров, например, внутренняя энергия (U) зависит от температуры, концентрации и т.д. Изменение функции состояния системы зависит только от их значений в начальном и конечном состояниях системы, но не зависит от пути перехода системы из одного состояния в другое.
Термодинамические процессы. Любое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) является термодинамическим процессом.
В зависимости от условий проведения процесса различают следующие виды процессов:
1) изотермический – процесс, протекающий при постоянной температуре (Т = const; Δ T = 0);
2) изобарический – процесс, протекающий при постоянном давлении (Р = const; Δ Р = 0);
3) изохорический – процесс, протекающий при постоянном объеме (V = const; Δ V = 0);
4) адиабатический – нет теплообмена системы с окружающим пространством, Δ Q = 0;
5) изобарно-изотермический – Т = const, Р = const; Δ T = 0,
Δ Р = 0;
6) изохорно-изотермический – Т = const, V = const; Δ Т = 0,
Δ V = 0;
В зависимости от характера протекания процесса различают процессы:
1) самопроизвольные – происходящие без затрат энергии извне;
2) несамопроизвольные – происходящие только при затрате энергии;
3) обратимые – процессы, допускающие возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения;
4) необратимые – процессы, протекающие полностью до конца в одну сторону;
5) равновесные – процессы, при которых система проходит через непрерывный ряд равновесных состояний под действием бесконечно малой разности сил.
Основной постулат термодинамики: Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти.
Это положение ограничивает размер систем, которые описывает термодинамика. Оно не выполняется для систем астрономического масштаба и микроскопических систем с малым числом частиц.
Второй постулат, или нулевой закон, термодинамики сформулирован в 1931 году английским физиком Р.Г. Фаулером: Две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом.
Второй постулат говорит о существовании особой интенсивной переменной, характеризующей состояние теплового равновесия и называемой температурой. Системы, находящиеся в тепловом равновесии, имеют одинаковую температуру.
Энергия. Внутренняя энергия. В каждом веществе запасено определенное количество энергии. Энергия – мера способности системы совершать работу и (или) переносить тепло, общая качественная мера движения и взаимодействияматерии.
Энергия химических соединений сосредоточена главным образом в химических связях. В ходе химической реакции одни связи разрушаются, другие образуются. Чтобы разрушить связь между двумя атомами, требуется затратить энергию. Когда химическая связь образуется, энергия выделяется.
Внутренняя энергия системы (U) – это сумма кинетической энергии (Е кин) движения всех частиц системы (молекул, атомов, ионов, электронов и др.) и потенциальной энергии (Е пот) взаимодействия между ними.
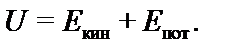
| (1) |
Внутренняя энергия системы – функция состояния, т.е. не зависит от процесса, а только от начального и конечного состояния системы.
Внутреннюю энергию нельзя определить, поскольку у системы нельзя отнять всю энергию. Рассчитывается не сама энергия, а ее изменение:
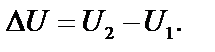
| (2) |
Этого достаточно для решения многих физико-химических проблем. Единица измерения энергии джоуль или калория (Дж, кал), 1 Дж = 1 Н∙м (ньютон∙метр); 1 ккал = 1000 кал = 4,184 кДж.
Работа и теплота. Изменение внутренней энергии системы связано с обменом энергией этой системы с окружающей средой. Этот обмен осуществляется в двух формах: либо в форме работы, либо в форме теплоты, либо одновременно. Работа и теплота – это формы передачи энергии от одной системы к другой.
Работа (А) – форма передачи энергии путем упорядоченного (направленного) движения частиц. Реализуется за счет различных форм движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс).
Теплота (Q) – форма передачи энергии путем неупорядоченного (хаотического) движения молекул. Реализуется путем теплопроводности.
Работа и теплота связаны с термодинамическим процессом и являются функциями перехода, т.е. их величина зависит от пути, по которому происходит изменение системы.
Если система получает некоторое количество энергии, передаваемое в форме тепла, то Q условно считают положительной величиной; если же система отдает энергию окружающей среде в форме тепла, то Q считают отрицательной величиной.
Date: 2015-09-18; view: 581; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |