
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Второй закон термодинамики
Множество различных процессов, которые идут вокруг нас, могут быть двух видов: самопроизвольные и несамопроизвольные процессы.
Самопроизвольные процессы протекают без затраты энергии из окружающей среды. Примеры: смешение газов, падение шарика, растворение в воде нитрата аммония NH4NO3.
Несамопроизвольные процессы протекают с затратой энергии из окружающей среды. Примеры: разделение смеси газов на отдельные газы, движение шарика вверх по наклонной плоскости.
Самопроизвольные процессы ведут к состоянию равновесия в системе (происходит выравнивание температуры, концентрации, давления и т.д.).
Количественной мерой приближения системы к состоянию равновесия является энтропия (S). Энтропия – это мера беспорядка в системе. С увеличением беспорядка в системе энтропия увеличивается.
Формулировка второго закона термодинамики:
– При протекании обратимых процессов в изолированной системе энтропия остается неизменной, а при необратимых − увеличивается.
– B изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии.
Когда энтропия системы достигает своего максимального значения, то система находится в состоянии термодинамического равновесия.
Математическое выражение второго закона термодинамики:
Δ S > 0 – критерий самопроизвольного процесса;
Δ S = 0 – критерий равновесного состояния системы.
Следует всегда помнить, что второй закон термодинамики не являетсяабсолютным; он теряет смысл для систем, содержащих малое число частиц, и для систем космического масштаба. Второй закон неприменим к живым объектам, которые представляют собой открытые системы и постоянно уменьшают энтропию, создавая идеально упорядоченные молекулы, например, за счет энергии солнечного света.
Термодинамическое толкование (объяснение) энтропии. При температуре абсолютного нуля энтропия идеального кристалла имеет минимальное значение энтропии (S = 0) и в кристалле наблюдается максимальный порядок. В этом случае макросостояние реализуется через одно микросостояние.
W =1, но S = k ∙ ln ∙ W, или S = k ∙ ln1, т.е. S = 0 и Δ S = 0.
При ΔS = 0 система находится в равновесии.
Изменение энтропии равно минимальной теплоте, подводимой к системе в обратимом изотермическом процессе, деленной на абсолютную температуру процесса, Дж/моль∙К. Математическая запись второго начала термодинамики для обратимых процессов:
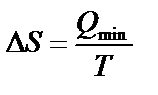 . (9)
. (9)
Единица измерения энтропии Дж/ (К∙моль).
Энтропия является функцией состояния системы и зависит от ее конечного и начального состояния, от температуры и давления в системе. В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии.
Стандартной энтропией реакции называется разность мольных энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов, взятых в стандартных состояниях:
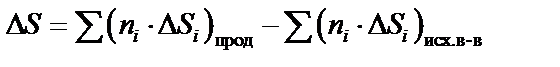 . (10)
. (10)
Факторы, влияющие на величину энтропии:
1) энтропия зависит от числа частиц. Чем частиц больше, тем больше хаос, а значит, энтропия;
2) агрегатное состояние вещества. В газе, где каждая частица движется независимо от других, неупорядоченность существенно больше, чем в идеальном кристалле. Жидкость занимает промежуточное положение. Соответственно, энтропия увеличивается в ряду S (т) < S (ж) < S (г). Уменьшение числа газовых молей означает уменьшение энтропии и наоборот;
3) строение вещества на молекулярном уровне. Чем сложнее вещество, тем энтропия будет выше.
Date: 2015-09-18; view: 298; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |