
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первого закона термодинамики
В прошлом столетии известный физик Гиббс ввел в практику тепловых расчетов новую функцию, которая по предложению Камерлинга-Оннеса названа энтальпи ей. Удельная энтальпия, т. е. энтальпия, отнесенная к 1 кг газа обозначается буквой i и измеряется в джоулях на килограмм (Дж/кг); она представляет собой сложную функцию вида
i = u + pv. (4.11)
Поскольку входящие в энтальпию величины и, р и v являются параметрами (функциями) состояния, следовательно и сама энтальпия будет также параметром (функцией) состояния.
Энтальпия является экстенсивным параметром, так как ее величина пропорциональна массе вещества. Если в качестве независимых параметров выбрать давление р и температуру Т, то можно получить для обратимых процессов другой вид аналитического выражения первого закона термодинамики:
dq = du + pdv = du + d(pv) - vdp =d(u + pv) - vdp.
Отсюда
dq = di - vdp, (4.12)
или
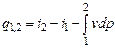 . (4.13)
. (4.13)
При p = const уравнение (4.12) принимает вид
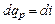 . (4.14)
. (4.14)
Элементарное приращение энтальпии di есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
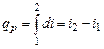 . (4.15)
. (4.15)
Из уравнения (4.12) следует, что
 , или
, или  . (4.16)
. (4.16)
Энтальпия больше теплоты на величину работы vdp, которая на pv -дитаграмме изображается элементарной площадкой abcd (рис. 4.6).
Изменение энтальпии полностью зависит от начального и конечного состояния рабочего тела и не зависит от промежуточных состояний. Изменение энтальпии газа в цикловых процессах равно нулю:
 .
.
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом v во внешнюю среду с давлением p.
Если рассматривать газ, находящийся в цилиндре, и поршень
|

Рис.4.6. К определению энтальпии процесса
с грузом, как одну систему, которую можно назвать расширенной системой, то полная энергия U этой системы складывается из внутренней энергии газа и потенциальной энергии поршня с грузом, равной pv:
 . (4.17)
. (4.17)
Энтальпией целесообразно пользоваться тогда, когда в качестве основных параметров принимают р и Т. Это наглядно можно видеть, если энтальпию i сравнить с внутренней энергией и. При v = const уравнение первого закона термодинамики dq = du + pdv превращается в dqv = du, или qv = u2 - u1, а при р= const qp = i 2 - i 1.
Энтальпия идеального газа, также как и внутренняя энергия, является функцией температуры и не зависит от других параметров:
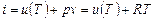 ,
,
и оба слагаемых являются функцией температуры и, следовательно
i = f (T).
Пример 4.1. Паротурбинная установка мощностью 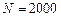 кВт имеет КПД 30%; на нее расходуется топливо с теплотой сгорания
кВт имеет КПД 30%; на нее расходуется топливо с теплотой сгорания 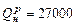 кДж/кг. Определить суточный расход топлива.
кДж/кг. Определить суточный расход топлива.
Р е ш е н и е. 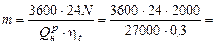 21333 кг,
21333 кг,
где 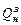 - нижняя теплота сгорания топлива по рабочей массе.
- нижняя теплота сгорания топлива по рабочей массе.
Пример 4.2. Атомные установки имеют мощность 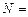 1 млн. кВт и более. Определить годовой расход ядерного топлива
1 млн. кВт и более. Определить годовой расход ядерного топлива 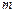 для такой установки, если 1 кг урана при расщеплении выделяет
для такой установки, если 1 кг урана при расщеплении выделяет 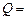 825×108 кДж теплоты, а работает реактор в течении года
825×108 кДж теплоты, а работает реактор в течении года 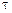 = 8000 ч.
= 8000 ч.
Р е ш е н и е. 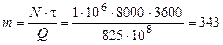 кг.
кг.
Date: 2015-05-09; view: 1140; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |
