
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия. Клазиус Рудольф Юлиус Эммануил (1818-1889) при исследовании термодинамических процессов рассматривал функцию состояния термодинамической системы вида
Клазиус Рудольф Юлиус Эммануил (1818-1889) при исследовании термодинамических процессов рассматривал функцию состояния термодинамической системы вида
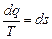 , Дж/кг×К, (6.1)
, Дж/кг×К, (6.1)
которую назвал энтропия s.
Необходимость введения новой функции состояния термодинамической системы определяется прежде всего тем, что сама теплота q не является функцией состояния и dq = du + pdv не является полным дифференциалом; dq представляет собой только некоторую бесконечно малую величину. Для того чтобы проинтегрировать правую часть уравнения dq = du + pdv, должна быть известна зависимость р от v или р от Т.
Энтропия является однозначной функцией состояния тела, ее изменение не зависит от промежуточных состояний тела (от характера процесса). Изменение энтропии в идеальном цикле (состоящем из обратимых процессов) равно нулю.
Изменение энтропии идеального газа в обратимых процессах можно определить, если подставить вместо dq его значение из первого закона термодинамики, предварительно выразив изменение внутренней энергии через теплоемкость du = cv dT. Будем иметь
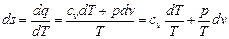 .
.
Из уравнения состояния идеального газа получим 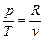 , подставив которое, получим
, подставив которое, получим
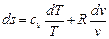 . (6.2)
. (6.2)
После интегрирования будем иметь для изменения энтропии
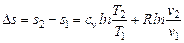 . (6.3)
. (6.3)
Для получения изменения энтропии как функции T и p нужно из уравнения (6.2) исключить v. Из уравнения Клапейрона после дифференцирования последнего получим
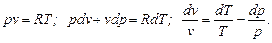
Подставляя значение dv / v в (6.2), имеем
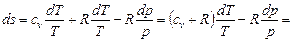
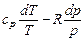 ,
,
так как по уравнению Майера cp - cv = R и сv + R = cp.
Интегрируя при ср = const, находим
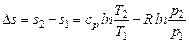 . (6.4)
. (6.4)
Для получения изменения энтропии как функции р и v следует в уравнении (6.2) исключить Т. Дифференцируя уравнение состояния, получим для Т:
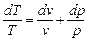 ,
,
подставив это выражение в (6.2), получим для изменения энтропии
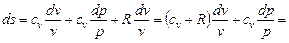
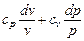
Интегрируя полученное выражение, получаем
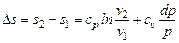 . (6.5)
. (6.5)
Так как изменение энтропии не зависит от характера процесса, полученные уравнения энтропии справедливы как для обратимых, так и для необратимых процессов.
Итак, полученные выражения для энтропии:
· при р = const: 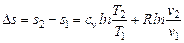 ;
;
· при v = const: 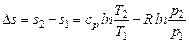 ;
;
· при Т = const: 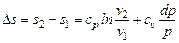 .
.
6.2. Тепловая Тs - диаграмма
Энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Удобнее всего энтропию сочетать с абсолютной температурой. Если энтропию s откладывать по оси абсцисс, а абсолютную температуру - по оси ординат, то получим координатную систему Тs, т. е. Ts - диаграмму, где состояние газа графически изображается точкой, а процесс в виде кривой, уравнение которой можно представить как Т = f (s). Элементарная теплота процесса dq = Tds изображается на диаграмме элементарной площадкой, высота которой равна Т, а основание ds, рис. 6.1.

Рис. 6.1. Ts – диаграмма
Площадь под кривой процесса 1-3-2 изображает в некотором масштабе теплоту, подводимую в этом процессе
q 1-2 = пл. 5-1-3-2-6-5 = 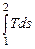 .
.
Если в процессе энтропия увеличивается, то это означает, что тепло подводится к телу и, наоборот, если энтропия уменьшается, то тепло отводится. Это означает, что энтропия и теплота имеют одинаковые знаки.
Обратимый круговой процесс на Ts - диаграмме изображается площадью фигуры 1-3-2-4-1.
Разность между подведенной и отведенной теплотой, согласно первому закону термодинамики, представляет собой полезную внешнюю работу, которую совершает 1 кг рабочего тела при круговом обратимом процессе над внешней системой:
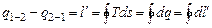 .
.
Таким образом, на Ts -диаграмме удельная работа тела (1 кг) при обратимом круговом процессе численно равна площади внутри замкнутой линии и дает наглядное представление об изменении температуры рабочего тела.
Общие вопросы исследования процессов
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работы газа. Причем количество теплоты, подводимое к телу или отводимое от него, зависит от характера процесса.
Основные процессы:
· изохорный, протекающий при постоянном объеме;
· изобарный, протекающий при постоянном давлении;
· изотермный, протекающий при постоянной температуре;
· адиабатный, протекающий при отсутствии теплообмена с внешней средой.
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными и характеризуются постоянством теплоемкости в процессе.
Для всех процессов принят общий метод исследований, который заключается в следующем:
· выводится уравнение кривой процесса на pv - и Ts -диаграммах;
· устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
· определяется изменение внутренней энергии по формуле, справедливой для всех процессов идеального газа:
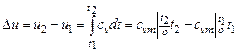 ,
,
или при постоянной теплоемкости: 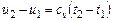 ;
;
· вычисляется работа изменения объема газа по основной формуле: 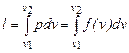 ;
;
· определяется количество теплоты, участвующее в процессе, по формуле:
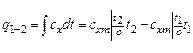 ;
;
· определяется изменение энтальпии в процессе по формуле, справедливой для всех процессов идеального газа:
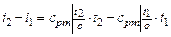 ;
;
или для постоянной теплоемкости:
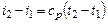 ;
;
· определяется изменение энтропии идеального газа по формулам:
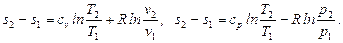
Рассматриваемые процессы считаются обратимыми.
Date: 2015-05-09; view: 1100; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |