
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методика проведения опытов
Для определения тепловых эффектов процессов, протекающих в водных растворах, используют простейший калориметр, приведенный на рис. 2.1.
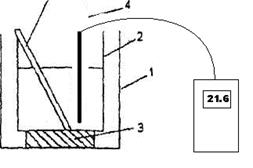
Рис.2.1. Схема калориметра:
1─внешний стакан калориметра; 2 ─ внутренний стакан калориметра;
3 ─ теплоизолирующая прокладка; 4 ─ термометр; 5 ─ мешалка
Так как слой воздуха, находящийся между стенками внешнего и внутреннего стаканов калориметра, является хорошим теплоизолятором, то все тепло, выделяющееся (или поглощающееся) в результате протекания реакции, идет на нагревание (или охлаждение) реакционной смеси и внутреннего стакана калориметра. Экспериментально определяется изменение температуры реакционной смеси, сопровождающее данный процесс. Для этого во внутренний стакан калориметра отмеривают с помощью мерного цилиндра 25–30 мл воды и измеряют начальную температуру tнач. с помощью термометра, который помещают непосредственно в жидкость, следя, чтобы он не касался дна и стенок внутреннего стакана (см. рис.2.1).
Не вынимая термометра из жидкости, во внутренний стакан засыпают сухую соль. Раствор перемешивают мешалкой до полного растворения, следя одновременно за показаниями термометра. Температура в ходе процесса может повышаться или понижаться. Конечную температуру tкон. фиксируют в тот момент, когда столбик термометра останавливается.
Все данные, необходимые для расчетов, сводят в таблицу (форма таблицы дана в описании опытов).
Тепловой эффект процесса, протекающего в калориметре, рассчитывается по формуле:
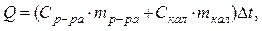
где Ср-ра ─ удельная теплоемкость раствора, находящегося во внутреннем стакане калориметра, которую можно принять равной удельной теплоемкости воды
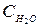 = 4,18 Дж/г·град;
= 4,18 Дж/г·град;
тр-ра ─ масса раствора во внутреннем стакане калориметра, г;
Скал ─ удельная теплоемкость внутреннего стакана калориметра, Дж/г∙град;
ткал ─ масса калориметра, г;
Δt ─ изменение температуры в ходе опыта, оС.
Учитывая, что удельная теплоемкость стекла, из которого сделан внутренний стакан калориметра, мала, вторым слагаемым можно пренебречь, тогда формула для расчета теплового эффекта примет вид:
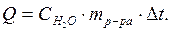
Опыт №1. Определение мольной теплоты растворения соли
Опыт проводят согласно описанию с выданной преподавателем навеской соли. Химическая формула соли и ее масса указаны на обертке навески. Данные, необходимые для расчета, сводят в таблицу 2.1.
Таблица 2.1. Параметры для расчета мольной теплоты растворения соли
| Химическая формула соли |  г
г
| 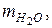 г
г
| 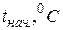
| 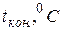
| 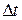
| 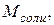 г/моль
г/моль
| 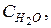 Дж/г·град
Дж/г·град
| 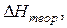 кДж/моль
кДж/моль
|
| 1. | 4,18 | |||||||
| 2. | 4,18 |
Мольную теплоту растворения, то есть теплоту, выделяющуюся или поглощающуюся при растворении в воде 1 моля соли, рассчитывают по формуле:
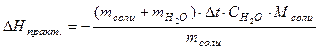 .
.
Пользуясь приведенной в конце работы таблицей, в которой даны теоретические значения мольных теплот растворения некоторых солей, рассчитайте относительную погрешность определения:
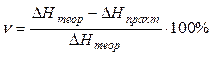 .
.
Опыт №2. Определение мольной теплоты гидратации соли
Гидратацией называют процесс присоединения к соли определенного количества молекул воды с образованием кристаллогидрата данной соли, например:
Na2СO3 + l0H2O = Na2CO3 · 10Н2О.
Для определения мольной теплоты гидратации в воде растворяют сначала навеску
безводной соли:
Na2СO3 + п H2O = Na2CO3 · п Н2О; ΔН растворения безводной.соли
а затем навеску кристаллогидрата данной соли:
Na2CO3 · 10Н2О + (п ─ 10)H2O = Na2CO3 · п Н2О; ΔН растворения кристаллогидрата
Оба процесса проводят согласно описанию, приведенному в практической части, и данные вносят в таблицу 2.1.
Пользуясь формулой для расчета мольной теплоты растворения, приведенной в 1-м опыте, рассчитывают ΔН растворения безводной соли и кристаллогидрата.
Теплоту гидратации вычисляют, пользуясь законом Гесса:
ΔН растворения безводной соли = ΔН гидратации + ΔН растворения кристаллогидрата
Относительную погрешность определения рассчитывают исходя из данных табл.2.2.
Таблица 2.2. Мольные теплоты растворения и гидратации
Date: 2015-09-24; view: 446; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |