
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение тепловых эффектов химических реакций
Цель работы: определить опытным путем тепловые эффекты процессов растворения из полученных данных, пользуясь законом Гесса, рассчитать теплоты гидратации солей.
Теоретическая часть
Все химические реакции сопровождаются выделением или поглощением энергии, чаще всего в виде тепла. Количество последней может быть измерено и выражено в единицах энергии (Дж, кал и т. д.).
Разница первоначального и конечного уровней энергии системы представляет собой энергетический эффект, или изменение энтальпии реакции, который обозначается ΔНr.
При экзотермических реакциях система с большим запасом энергии переходит в состояние с меньшим запасом энергии. Такие реакции сопровождаются выделением тепла, и их тепловой эффект считается отрицательным (ΔНr <0).
При эндотермических реакциях, наоборот, система с меньшим запасом энергии переходит в состояние с более высоким запасом энергии. Такие реакции сопровождаются поглощением тепла, и их тепловой эффект принято считать положительным (ΔНr >0).
Для термохимических расчетов большое значение имеют величины энтальпий образования веществ. Под энтальпией образования вещества понимается изменение энтальпии реакции образования одного моля сложного вещества из простых веществ, например:
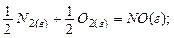
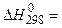 +90,4 кДж/моль.
+90,4 кДж/моль.
Верхний и нижний индексы при ΔН указывают на то, что энтальпия образования приведена к стандартным условиям (давление 101325 Па, или 1 атм и температура 298 К, или 25 0С).
Значения энтальпий образования веществ приведены в таблицах термодинамических потенциалов.
Термохимические расчеты основаны на использовании закона Гесса и вытекающих из него следствий:
1. Тепловой эффект химического процесса равен сумме тепловых эффектов всех промежуточных стадий процесса.
Например, процесс получения двуокиси углерода из угля и кислорода может быть проведен в одну стадию:
С(т) + О2(г) = СО2(г); ΔНr = ─ 94 ккал.
Но этот же процесс можно провести в две стадии:
С(т) + 1/2 О2(г) = СО(г); ΔНr = ─ 26,4 ккал.
CO(г) + 1/2O2(г) = CO2(г); ΔНr = ─ 67,6 ккал.
Согласно закону Гесса, сумма тепловых эффектов двух последних реакций должна равняться тепловому эффекту первой реакции, что и наблюдается в действительности: {─ 26,4 ─ 67,6 = ─ 94 (ккал)}.
2. Тепловой эффект химической реакции равен разности теплот образования конечных и исходных участников реакции, умноженных на их стехиометрические коэффициенты (т. e. коэффициенты перед формулами данных веществ в уравнении реакции).
Например, реакция горения пропана протекает по схеме:
С3Н8(г) + 5Ог(г) = 3СО2(г) + 4Н2О(г).
Теплоты образования 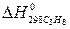 ;
; 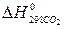 и
и 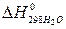 соответственно равны ─103,8; ─393,6 и ─241,9 кДж/моль.
соответственно равны ─103,8; ─393,6 и ─241,9 кДж/моль.
Тепловой эффект реакции горения С3Н8(г) рассчитывается по формуле:
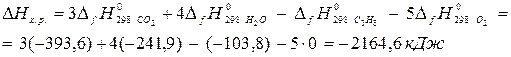
Практическая часть
Date: 2015-09-24; view: 562; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |