
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Скорость химических реакций. Химическое равновесие. Цель работы: изучить влияние различных факторов на скорость химической реакции и смещение химического равновесия
Цель работы: изучить влияние различных факторов на скорость химической реакции и смещение химического равновесия.
Теоретическая часть
Скорость химической реакции измеряется изменением концентраций реагирующих веществ в единицу времени. Под концентрацией вещества понимают количество его в единице объема. Концентрацию обычно выражают числом молей вещества, содержащихся в одном литре.
Скорость реакции зависит от природы реагирующих веществ и от условий ее протекания. Главными факторами, влияющими на скорость реакции, являются концентрации реагирующих веществ и температура.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
Эта зависимость носит название закона действия масс.
Например, для реакции синтеза аммиака, протекающей по уравнению:
N2 + 3Н2 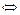 2NH3; ΔНr = ─ 92,6 кДж,
2NH3; ΔНr = ─ 92,6 кДж,
зависимость скорости реакции от концентраций реагирующих веществ имеет следующий вид:
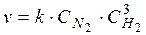 ,
,
где 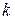 ─ константа скорости данной реакции
─ константа скорости данной реакции
Закон действия масс строго применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют также твердые вещества, концентрация которых постоянна, то данная концентрация не включается в зависимость v = f(c).
Зависимость скорости реакции от температуры выражается экспериментальным правилом Вант - Гоффа, согласно которому с повышением температуры на каждые 10° скорость реакции увеличится в 2 – 4 раза:
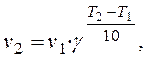
где v2 и v1 ─скорости реакции соответственно при температурах Т2 и Т1;
γ ─ температурный коэффициент реакции, γ = 2... 4.
С течением времени скорость реакции уменьшается, так как по мере взаимодействия веществ уменьшаются их концентрации. Но если реакция обратима и протекает в замкнутом пространстве, то одновременно с уменьшением скорости прямой реакции vпр . увеличивается скорость обратной реакции vобр. вследствие накопления продуктов прямой реакции. Когда обе скорости становятся одинаковыми, наступает состояние равновесия, и дальнейшее изменение концентраций всех участвующих в реакции веществ прекращается.
Соотношение между концентрациями исходных веществ и продуктов в состоянии равновесия является постоянным для реакции. Так, для реакции синтеза аммиака выражение для константы равновесия имеет вид:
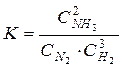 .
.
Состояние химического равновесия в основном зависит от 3-х факторов:
а) концентраций участников реакции,
б) температуры,
в) давления (если в реакции участвуют газообразные вещества).
При изменении хотя бы одной из указанных величин равновесие нарушается, и концентрации всех участвующих в реакции веществ начинают изменяться до тех пор, пока при измененных условиях скорости прямой и обратной реакций снова не сравняются. Этот процесс называется смещением или сдвигом равновесия.
Направление, в котором смещается равновесие, определяется принципом Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в направлении, противодействующем данному воздействию.
Так, равновесие процесса синтеза аммиака можно сдвинуть в прямом направлении (вправо), если:
а) увеличить концентрации N2 или Н2 или уменьшить концентрацию NH3;
б) уменьшить температуру;
в) увеличить давление в системе.
Практическая часть
Опыт № 1. Влияние концентраций реагирующих веществ на скорость реакции
В пронумерованные пробирки налить тиосульфат натрия Nа2S2O3 и воду в соответствии с заданием (табл. 3.1). Затем в 1-ю пробирку добавить указанное в задании количество капель серной кислоты H2SO4 и отметить время, прошедшее с момента прикапывания H2SO4 до появления первых признаков выпадающей в осадок серы (помутнение реакционной смеси):
Na2S2O3 + H2SO4 = S + SO2 + Na2SO4 + Н2О.
Для того чтобы не пропустить момент появления мути, необходимо рядом с пробиркой, в которой находится реакционная смесь, поместить контрольную пробирку с дистиллированной водой.
Таблица 3.1. Список заданий к опыту №1 (количества реактивов даны в каплях)
| Название реактива | № пробирки | Номера заданий | |||||||
| Na2S2O3 | |||||||||
| Н2О | |||||||||
| h2so4 |
Аналогично провести опыты с растворами в остальных пробирках. Полученные данные записать в таблицу 3.2.
По данным таблицы построить график зависимости реакции v от концентрации С и сделать вывод о характере данной зависимости.
Памятка для построения графиков
При построении графиков на оси абсцисс откладывается независимая переменная (аргумент), а по оси ординат – зависимая (функция). Оси координат разбиваются на равные промежутки согласно выбранному масштабу. Масштаб выбирается таким образом, чтобы максимальному значению откладываемой величины соответствовал отрезок в 10 см на координатной оси. Экспериментальные точки ставятся на пересечении перпендикуляров, восстановленных из точек на координатных осях, соответствующих параметрам данного опыта. Графиком зависимости является плавная (без изломов) линия, объединяющая по возможности все экспериментальные точки.
Таблица 3.2. Параметры для определения скорости реакции
| № пробирки | Кол-во капель Na2S2O3 , п1 | Кол-во капель Н2О, п2 | Кол-во капель H2SO4, п3 | Относительная концентрация
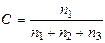
| Время помутнения t,c | Относительная скорость реакции
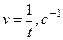
|
Опыт № 2. Влияние температуры на скорость реакции
Подготовить 3 одинаковые пробирки, в каждую из которых налить Na2S2О3 и Н2О в количествах, соответствующих пробирке №1 в 1-м опыте. Подготовленные пробирки поместить на водяную баню, заполненную горячей водой (см. рис.3.1).






























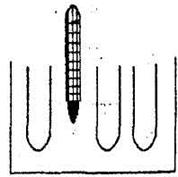
Рис.3.1. Установка для изучения влияния температуры
на скорость реакции
В эту же баню поместить термометр. Подождать 2─3 мин, чтобы температура содержимого пробирок сравнялась с температурой воды в бане. Отметить температуру опыта, капнуть в 1-ю пробирку H2SO4, и измерить время от момента прикапывания H2SO4 до появления мути. Подождать, пока температура воды в бане уменьшится на 5─10°, и повторить опыт для 2-й пробирки и т. д. Результаты опытов записать в табл. 3.3. Сюда же (в табл. 3.3), измерив комнатную температуру, вписать время помутнения для первой пробирки из опыта №1.
Таблица 3.3 Параметры для определения скорости реакции
| № пробирки | Температура опыта Т, 0C | Время помутнения t,c | Относительная скорость
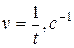
|
По данным таблицы построить график зависимости скорости реакции от температуры и сделать вывод о характере данной зависимости.
Опыт №3. Влияние площади поверхности на скорость реакции в гетерогенной системе
Налить в две пробирки по 2─3 мл 2н раствора соляной кислоты; взять два одинаковых кусочка мела и один из них растереть в ступке. Высыпать в одну пробирку порошок, а в другую поместить кусочек мела. В какой пробирке реакция идет быстрее? Напишите уравнение реакции взаимодействия мела с соляной кислотой.
Опыт №4. Влияние катализатора на скорость химических реакций
К 2 мл пероксида водорода Н2О2 прибавить немного порошка МnО2, и наблюдать энергичное разложение перекиси водорода с выделением кислорода. Написать уравнение протекающей реакции и сделать вывод.
Опыт №5. Смещение химического равновесия при изменении концентрации реагирующих веществ
В пробирку налить 20─25 капель воды и 1–2 капли растворов хлорида железа (III) и роданида аммония:
FeCl3 + 3NH4CNS 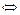 Fe(CNS)3 + 3NH4C1.
Fe(CNS)3 + 3NH4C1.
Окрашенный раствор (красная окраска обусловлена образованием роданида трехвалентного железа) разлить поровну в 4 пробирки. В одну пробирку добавить 2─3 капли FeCl3, а в другую ─ NH4CNS. В третью пробирку всыпать немного сухого хлорида аммония NH4C1 и сильно взболтать. Что наблюдается? Сравнить цвета растворов с окраской четвертой (контрольной) пробирки. Дать объяснение изменениям окраски.
Лабораторная работа №4
Date: 2015-09-24; view: 934; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |