
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ациклические аминокислоты
Моноаминомонокарбоновые кислоты содержат в молекуле одну аминную (—NH2) и одну карбоксильную (—СООН) группы. Растворы этих аминокислот близки к нейтральному. Простейшей из моноамино- монокарбоновых кислот является глицин, или гликокол (аминоуксусная кислота) СООН-СН2—NH2, открытый в 1820 г. в продуктах гидролиза желатины. Эта аминокислота содержится в составе почти всех белков растительного и животного происхождения. Сладковата на вкус и хорошо растворима в воде. Аминоуксусная кислота участвует в синтезе многих соединений: гемоглобина, глутатиона, гиппуровой кислоты, креатина, пуриновых оснований, желчных кислот и т. д. В организме человека и высших животных глицин может синтезироваться из других аминокислот.
Аланин (α-аминопропионовая кислота) впервые был выделен из гидролизата шелка в 1888 г. Алании и его производные (серии, цистеин, цистин, фенилаланин, тирозин, триптофан и гистидин) составляют 60—65% всех аминокислот белков. Из аланина образуются серии и цистеин:
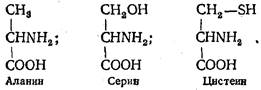
Алании является предшественником синтезируемых в организме карнозина, ансерина, пантотеновой кислоты, коэнзима А и входит в состав большинства животных белков.
Серин (α-амино-β-оксипропионовая кислота) является составной частью многих белков. Получен из гидролизата фиброина шелка в 1865 г. В большей степени, чем аланин, вступает в различные химические реакции, что обусловлено наличием в молекуле серина трех функциональных групп: аминной, карбоксильной и гидроксильной.
Цистеин (α-амино-β-тиопропионовая кислота) выделен из гид-ролизатов белков шерсти, рогов и копыт в 1890 г. Содержится во многих белках (больше всего — в белках ороговевших тканей). Кроме того, цистеин входит в состав тиоловых ферментов благодаря наличию сульфгидрильной группы (—SH).
При конденсации двух молекул цистеина образуется молекула цистина:

Цистин (α,α'-диамино-β'-дитиопропионовая кислота) обнаруживается в гидролизатах белков кожи, очень плохо растворяется в воде, слабых кислотах и щелочах. Эта аминокислота содержит в своем составе две аминные и две карбоксильные группы. Образуется на завершающем этапе белкового синтеза.
Треонин (α-амино- -оксимасляная кислота) получен из гидролизатов казеина и фибрина в 1935 г. Имеет два асимметрических атома углерода в α - и β-положениях:
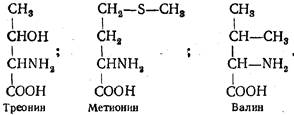
Метионин (α-амино-γ-метилтиомасляная кислота) выделен из продуктов кислотного гидролиза казеина в 1922 г. Играет важную роль в организме, поскольку является донором метальных групп, участвует в биосинтезе холина, адреналина, цистеина и других веществ. В организме не синтезируется, поэтому должен обязательно поступать с пищей.
Валин (α-аминоизовалериановая, или α-амино-β-метилмасляная, кислота) получен из гидролизата поджелудочной железы в 1879 г. Высокис водержанием валина характеризуются белки эластин (13—14%), казеин (7-8%) и миоглобин (4,1%). В тканях человека и высших животных не синтезируется.
Лейцин (α-аминоизокапроновая, или α-амино-γ-метилвалериановая, кислота) широко представлен в составе большинства белков. Впервые выделен из сыра в 1819 г. Богаты лейцином овальбумин яичного белка, миозин мышечной ткани, казеиноген молока, фибриноген крови. Лейцин является промежуточным соединением при биосинтезе холестерина.
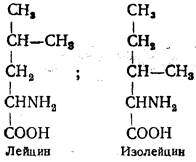
Изолейцин (α-амино-β-метилвалериановая кислота) содержится в белках в небольших количествах. Открыт Ф. Эрлихом в 1904 г. в гидролизате фибрина. Имеет в молекуле два асимметрических атома углерода. Лейцин и изолейцин в тканях животных и человека не синтезируются.
Моноаминодикарбоновые кислоты содержат в составе молекулы одну аминную и две карбоксильные группы, в связи с чем проявляют кислотный характер.
Аспарагиновая (аминоянтарная) кислота получена из гидролизатов растительных белков в 1868 г. Широко распространена, синтезируется в животных тканях. Играет важную роль в обезвреживании аммиака в организме путем образования амидов, участвует в синтезе мочевины, пиримидиновых оснований и в переаминировании аминокислот.

Глутаминовая (α-аминоглутаровая) кислота впервые выделена из гидролизата пшеничного зерна в 1868 г. Входит в состав белков растительного и животного происхождения. Так же, как и аспарагиновая кислота, участвует в реакциях переаминирования и связывания аммиака. Глутаминовая кислота принимает также участие в образовании у-аминомасляной кислоты, глутатиона, синтезе орнитина и глюкозы, реакциях окислительного дезаминирования, декарбоксилирования аминокислот.
Аспарагин и глутамин являются производными двух предыдущих аминокислот, в которых карбоксильные группы, удаленные от аминогрупп, амидированы. Амиды аспарагиновой и глутаминовой кислот входят в состав белков и играют важную роль в метаболизме:
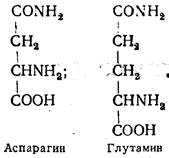
Диаминомонокарбоновые кислоты. В состав белков организма человека и животных входят аминокислоты, содержащие две аминные и одну карбоксильную группы, что обусловливает их основный характер.
Аргинин (α-амино-δ-гуанидинвалериановая кислота) впервые получен из гидролизата ростков люпина в 1886 г. Входит в состав почти всех растительных и животных белков. Много аргинина содержится в эмбриональных тканях, опухолях и в белках спермы рыб. Участвует в образовании креатина, важнейшего субстрата мышечной ткани. При гидролизе образует аминокислоту орнитин и мочевину.
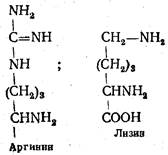
Лизин (α,ε-диаминокапроновая кислота) выделен из гидролизата казеина в 1889 г., синтезирован в 1902 г. Входит в состав почти всех белков. Высоким содержанием лизина характеризуется фибриноген (до 5—10 %), ядерные белки — протамины и гистоны. В животных тканях не синтезируется. Характерной особенностью лизина является присоединение протона к ε-аминогруппе. При этом образуется положительно заряженная NH3+-гpyппa. В белках, где содержится много лизина, образуется активный центр в виде поликатиона, что обусловливает определенные биологические свойства этих белков.
В очень малом количестве в белках животных тканей обнаружена аминокислота, сходная с лизином,— δ-оксилизин H2N—СН2—СНОН—NH2(СН2)2—СН—СООН (α,ε-диамино-δ-оксикапроновая кислота), которая образуется из лизина уже после включения его в белок.
Date: 2015-09-22; view: 2564; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |