
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кислотно-основных индикаторов
| Индикатор | Интервал перехода окраски | рТ |
| Тропеолин 00 | 1,4 – 3,2 | 2,0 |
| Метиловый оранжевый | 3,1 – 4,4 | 4,0 |
| Метиловый красный | 4,2 – 6,2 | 5,5 |
| Лакмус | 5,0 – 8,0 | 7,0 |
| Тимоловый синий | 8,0 – 9,6 | 8,0 |
| Фенолфталеин | 8,2 – 10,0 | 9,0 |
| Тимолфталеин | 9,4 – 10,6 | 10,0 |
Ориентировочно подобрать индикатор можно эмпирическим путем, исходя из свойств продуктов реакции нейтрализации.
Однако, более точный выбор индикатора осуществляется расчетным путем по кривой титрования, представляющей собой график зависимости изменения рН раствора от объема добавленного титранта.
Известно, что при титровании сильных кислот и сильных оснований можно применять любые кислотно-основные индикаторы, имеющие интервал перехода окраски от рН 4 до рН 10, так как в результате реакции образуется вода и негидролизующаяся соль, а реакция среды в точке эквивалентности становится нейтральной.
При добавлении избытка титрованного раствора концентрации ионов H3O+ или OH- в растворе быстро возрастает, что приводит к резкому изменению окраски реакционной среды.
При титровании слабых кислот, слабых оснований или их солей, следует подбирать индикатор таким образом, чтобы показатель титрования (рТ) индикатора совпадал с рН среды в конечной точке титрования или находился вблизи его.
При титровании сильных кислот сильными основаниями (и наоборот) вблизи конца титрования происходит резкий скачок рН. При титровании слабых кислот, слабых оснований или их солей скачок рН значительно меньше. В этих случаях для выбора индикатора рассчитывают значение рН в точке эквивалентности с использованием констант ионизации по следующим формулам:
· для титрования слабой кислоты сильным основанием:
рН = 7 + 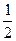 рКА +
рКА + 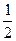 lg С (1)
lg С (1)
· для титрования слабого основания сильной кислотой:
рН = 7 - 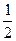 рКВ +
рКВ + 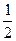 lg С (2)
lg С (2)
· для титрования солей образованных слабыми кислотами и сильными основаниями:
рН =  -
- 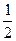 lg С (3)
lg С (3)
где рК – отрицательный десятичный логарифм константы ионизации;
С – концентрация соли или кислоты, образующихся в конце титрования,
моль/литр.
В табл.7 приведены общие рекомендации по выбору кислотно-основного индикатора в зависимости от «силы» определяемых соединений.
Таблица 7
Date: 2015-09-18; view: 597; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |