
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Общие принципы лучевой терапии 3 page
лучение пучками частиц. Частицы делят на тяжелые (нейтроны), заряженные (протоны) и тяжелые заряженные (ионы неона). Как полагают, различия в физических свойствах и энергии частиц позволят подводить высокие суммарные очаговые дозы без дополнительного лучевого повреждения нормальных тканей. Теоретическое преимущество облучения протонами — возможность конформного распределения дозы. В контролируемом клиническом испытании, проведенном в Массачусетском
Таблица 28.11. Результаты внутритканевой и дистанционной лучевой терапии, а также комбинированного лечения рака предстательной железы
Авторы
Число больных Исследование
Результаты
 Seung(1998)
Seung(1998)
D'Amico(1998)
King (1998)
Brachman(1998) Zelefsky (1998)
ДЛТ-187
ВЛТ - 66. ДЛТ - 766. РП - 888
ВЛТ - 63. ДЛТ - 85. РП-73
ДЛТ - 933. ВЛТ - 669
ДЛТ - 743. ВЛТ - 245
Результаты ДЛТ у больных из Калифорнийского университета (Сан-Франциско), считавшихся кандидатами для ВЛТ, сравнили с литературными данными Радикальная позадилобковая простатэкто-мия в Пенсильванском университете, ДЛТ в Объединенном центре
Сравнение результатов лечения больных при Т1—2, получавших лечение в Йельском университете
Ретроспективное исследование результатов лечения в одной многопрофильной больнице
Ретроспективное исследование результатов лечения рака предстательной железы ранних стадий, проведенного в Мемориальном онкологическом центре Слоуна и Кеттеринга
Результаты различны, часть схожа с результатами ДЛТ
Результаты лечения больных с низким риском смерти от рака предстательной железы примерно одинаковы при любом методе. При умеренном и высоком риске ВЛТ оказалась менее эффективна ДЛТ менее эффективна, чем РП или ВЛТ. Средняя суммарная очаговая доза при ДЛТ 66 Гр. У 42% больных индекс Глисона был более 7. Уровень ПСА более 10 нг/мл наблюдался у 42% больных, получавших ДЛТ, у 22% больных, получавших ВЛТ, и у 24% больных после РП (в отсутствие метастазов в тазовые лимфоузлы)
При опухолях с индексом Глисона не менее 7 или уровне ПСА > 10 нг/мл ДЛТ статистически значимо эффективнее ВЛТ Высокая частота излечения (по уровню ПСА) после как ДЛТ, так и ВЛТ. Более частое лучевое повреждение мочевых путей при ВЛТ
ВЛТ — внутритканевая лучевая терапия; ДЛТ — дистанционная лучевая терапия; РП — радикальная простатэктомия.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
 госпитале, облучение смешанными пучками фотонов и протонов статистически значимо снижало частоту рецидивов, но не влияло на безрецидивную и общую выживаемость больных с низкодифференцированными опухолями предстательной железы. В других группах больных никаких преимуществ отмечено не было, а частота кровотечений из прямой кишки после облучения смешанными пучками была статистически значимо выше (р = 0,002). Эти наблюдения согласуются с данными других авторов, изучавших зависимость между эффективностью облучения протонами в разных дозах и динамикой уровня ПСА при низкодифференцированном раке предстательной железы. Иными оказались результаты клинического испытания, проведенного в Медицинском центре Лома-Линдского университета. Через 4 года наблюдения частота ремиссии по уровню ПСА после облучения смешанными пучками фотонов и протонов, трехмерной конформной лучевой терапии и радикальной простатэктомии оказалась одинакова. Осложнения после облучения смешанными пучками встречались реже, чем в клиническом испытании, проведенном в Массачусетском госпитале. При более тщательном анализе оказалось, что для сравнения авторы использовали результаты клинических испытаний трехмерной конформной лучевой терапии с самой высокой частотой осложнений. Предварительные результаты кооперированного клинического испытания I—II фазы Исследовательской группы по лучевой терапии злокачественных опухолей № 9406 (RTOG 9406) доказывают, что при трехмерной конформной лучевой терапии можно подводить те же дозы ионизирующего излучения при гораздо меньшей частоте осложнений.
госпитале, облучение смешанными пучками фотонов и протонов статистически значимо снижало частоту рецидивов, но не влияло на безрецидивную и общую выживаемость больных с низкодифференцированными опухолями предстательной железы. В других группах больных никаких преимуществ отмечено не было, а частота кровотечений из прямой кишки после облучения смешанными пучками была статистически значимо выше (р = 0,002). Эти наблюдения согласуются с данными других авторов, изучавших зависимость между эффективностью облучения протонами в разных дозах и динамикой уровня ПСА при низкодифференцированном раке предстательной железы. Иными оказались результаты клинического испытания, проведенного в Медицинском центре Лома-Линдского университета. Через 4 года наблюдения частота ремиссии по уровню ПСА после облучения смешанными пучками фотонов и протонов, трехмерной конформной лучевой терапии и радикальной простатэктомии оказалась одинакова. Осложнения после облучения смешанными пучками встречались реже, чем в клиническом испытании, проведенном в Массачусетском госпитале. При более тщательном анализе оказалось, что для сравнения авторы использовали результаты клинических испытаний трехмерной конформной лучевой терапии с самой высокой частотой осложнений. Предварительные результаты кооперированного клинического испытания I—II фазы Исследовательской группы по лучевой терапии злокачественных опухолей № 9406 (RTOG 9406) доказывают, что при трехмерной конформной лучевой терапии можно подводить те же дозы ионизирующего излучения при гораздо меньшей частоте осложнений.
Преимущество облучения нейтронами — относительная независимость от кислородного эффекта и меньшая вероятность репарации сублетального повреждения клеток. В клиническом испытании Исследовательской группы по лучевой терапии злокачественных опухолей № 7704 (RTOG 7704) сравнили эффективность высокодозной у-терапии и высокодозного облучения смешанными пучками фотонов и нейтронов. Через 10 лет наблюдения после облучения смешанными пучками статистически значимо реже наблюдались рецидивы (30 и 42% соответственно, р = 0,04) и была выше общая выживаемость (46 и 26% соответственно, р = 0,04). В более позднем контролируемом клиническом испытании облучение быстрыми нейтронами снижало частоту рецидивов (по данным обследования и динамике уровня ПСА) по сравнению с у-терапией.
Полагают, что тяжелые заряженные частицы обладают преимуществами по сравнению и с нейтронами, и с протонами. Первый опыт облучения тяжелыми заряженными частицами обнадеживает, но число больных невелико, период наблюдения сравнительно короток, а специальное оборудование имеют лишь немногие клиники. Чтобы узнать, как этот вид лучевой терапии влияет на выживаемость, нужны клинические испытания с более длительным наблюдением.
Послеоперационная лучевая терапия
Цель послеоперационной лучевой терапии — обеспечить радикальность местного воздействия на опухоль за счет уничтожения оставшихся опухолевых клеток в ложе удаленной предстательной железы, окружающих тканях и регионарных лимфоузлах. Лучевая терапия после хирургического лечения рака предстательной железы показана при: 1) наличии опухолевых клеток по краю резекции, 2) прорастании семенных пузырьков, 3) поражении регионарных лимфоузлов, 4) прорастании капсулы предстательной железы, 5) повышении уровня ПСА и 6) рецидиве, диагностированном при биопсии. Каждый из перечисленных факторов (кроме последнего, разумеется) повышает риск рецидива. Согласно первым клиническим испытаниям, дистанционная лучевая терапия снижает частоту рецидивов после радикальной простатэктомии у больных с микроскопической остаточной опухолью. У больных с рецидивом рака предстательной железы, получавших до этого адъювантную лучевую терапию, выше безрецидивная выживаемость, больше срок до появления отдаленных метастазов, реже диагностируется прогрессирование по повышению уровня ПСА в сыворотке, чем у больных, получавших лучевую терапию уже по поводу рецидива заболевания, Медиана безрецидивного периода (отсутствие опухоли подтверждено биопсией) после лучевой терапии по поводу рецидива рака предстательной железы составляет 3 года. Влияние послеоперационной лучевой терапии на выживаемость — вопрос нерешенный, но логично предположить, что у больных без отдаленных метастазов она должна быть эффективной.
Частые осложнения при послеоперационной лучевой терапии объясняются, скорее всего, использованием старых методик облучения. В недавних исследованиях, где применяли современное оборудование и планирование лечения, осложнения лучевой терапии отмечались довольно редко.
После операции ложе предстательной железы обычно облучают с 4 противолежащих полей с добавлением двухосевой ротации с углом качания 120° либо применяют более сложные методики, в частности трехмерную конформную лучевую терапию (по той же методике, как при радикальной лучевой терапии). Суммарная очаговая доза составляет 45—68 Гр в зависимости от вероятности остаточной опухоли и тактики лечения. В нашей клинике при наличии опухолевых клеток по краю резекции, равно как и при рецидиве рака предстательной железы после хирургического лечения, мы проводим дистанционную лучевую терапию в суммарной очаговой дозе 70 Гр. При крупных рецидивных опухолях подводится более высокая доза ионизирующего излучения.
Осложнения
Большинство больных в процессе лечения отмечают учащенное и болезненное мочеиспускание. При облучении всего таза возможен легкий понос. Примерно у 10% больных наблюдаются незначительные кровотече-
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
 ния из прямой кишки, которые прекращаются самопроизвольно. Частота этого осложнения зависит от суммарной очаговой дозы и объема мишени. У больных, перенесших ТУР предстательной железы, бывает недержание мочи. Гематурия и стриктуры мочеиспускательного канала встречаются менее чем у 7% больных. Изредка наблюдается анальное недержание. У 10% больных из-за уменьшения растяжимости прямой кишки возникают тенезмы.
ния из прямой кишки, которые прекращаются самопроизвольно. Частота этого осложнения зависит от суммарной очаговой дозы и объема мишени. У больных, перенесших ТУР предстательной железы, бывает недержание мочи. Гематурия и стриктуры мочеиспускательного канала встречаются менее чем у 7% больных. Изредка наблюдается анальное недержание. У 10% больных из-за уменьшения растяжимости прямой кишки возникают тенезмы.
Импотенция — самое неприятное для больных, частое и необратимое осложнение лучевой терапии по поводу рака предстательной железы. Среди больных с исходно нормальной потенцией после лечения ее утрачивают 35—40%. Раньше считали, что после контактной лучевой терапии это осложнение возникает реже, чем после дистанционной. Однако позже выяснилось, что после трехмерной конформной лучевой терапии и внутритканевой лучевой терапии |251 частота импотенции через 5 лет после лечения одинакова. Согласно опросам больных, у 80% через 15—20 мес после лечения потенция сохраняется. Но при этом половые сношения происходят реже и приносят меньше удовлетворения. В большинстве случаев уменьшается объем эякулята. В дальнейшем риск импотенции увеличивается из-за старения и поздних лучевых реакций.
Ранние лучевые повреждения мочевых путей при контактной лучевой терапии развиваются чаще и длятся дольше, чем при трехмерной конформной. Чаще возникают и стриктуры мочевых путей. Острая обструкция мочевых путей наблюдается почти у 20%, недержание мочи — у 50% больных во время контактной лучевой терапии. Последнее характерно для перенесших ТУР предстательной железы. Лучевой проктит встречается так же часто, как при трехмерной конформной лучевой терапии, или несколько реже.
Рак мочевого пузыря
Лучевая терапия как самостоятельный метод лечения
В США основной метод лечения рака мочевого пузыря — хирургический. Как правило, лучевая терапия в самостоятельном виде проводится только больным, которым операция противопоказана. Неудивительно, что в большинстве ретроспективных исследований выживаемость больных после лучевой терапии ниже, чем после хирургического лечения. Ни одного методически безупречного контролируемого клинического испытания, сравнивающего эффективность лучевой терапии и хирургического лечения при раке мочевого пузыря, нет. В отличие от США в Канаде и Великобритании лечение рака мочевого пузыря, как правило, начинают с дистанционной лучевой терапии.
Эдинбургское исследование — единственное из крупных исследований лучевой терапии при раке мочевого пузыря, лишенное серьезных погрешностей. По его данным, частота полных ремиссий при любом Т состав-
ляет 45%, частота рецидивов через 5 лет при опухолях Т1— 3 75%, при опухолях Т4 — 84%. Ремиссии чаще наблюдаются при низкодифференцированных опухолях, но выживаемость при этом ниже из-за более высокого риска диссеминации. Частота ремиссий, вероятность отдаленных метастазов и выживаемость после лучевой терапии как самостоятельного метода лечения зависят от нескольких факторов. Это индекс Т, означающий глубину инвазии опухоли, степень дифференцировки, исходный уровень гемоглобина, наличие остаточной опухоли после ТУР и обструкции мочеточника, выявленной методами лучевой диагностики. Многофакторный анализ, проведенный в Онкологическом центре М. Д. Андерсона, показал, что самый важный независимый прогностический фактор, позволяющий судить об исходе болезни, — это полная ремиссия после лечения.
Возможно, эффективность лучевой терапии зависит и от ее длительности. В частности, она ниже при расщепленном курсе лучевой терапии. После непрерывного курса лучевой терапии длительностью 44 сут и менее и 45—74 сут ремиссии отмечаются одинаково часто. В клинических испытаниях модифицированных режимов фракционирования отмечено повышение 10-летней выживаемости при их использовании.
Дистанционную лучевую терапию при раке мочевого пузыря проводят по той же методике, что и при раке предстательной железы. Лечение обычно начинают с облучения всего таза с 4 противолежащих полей (15—25 МэВ). Верхняя граница полей находится либо на уровне межпозвоночного диска L5—S1, либо на уровне середины крестцово-подвздошного сустава. Нижняя граница проходит, как правило, по нижнему краю запирательного отверстия. При прорастании опухоли в предстательную железу поля расширяют до нижнего края седалищных бугров. Боковые границы переднего и заднего полей проходят на 1,5—2,0 см латеральнее внутренних границ тазовых костей, передняя граница боковых полей — чуть спереди от мочевого пузыря, а задняя — на 2—3 см позади мочевого пузыря, захватывая крестцовые лимфоузлы. Облучение с 3 полей — переднезаднего и 2 боковых используется реже. Оно применяется и как основная методика лечения, и как способ подведения дополнительной дозы ионизирующего излучения непосредственно к мочевому пузырю (объем мишени в виде перевернутого конуса).
После подведения суммарной очаговой дозы 45—50 Гр поля облучения сужают и доводят суммарную очаговую дозу в меньшем объеме мишени до 64,8—68,4 Гр. Конечный объем мишени планируют так, чтобы в него не попадала хотя бы часть непораженной стенки мочевого пузыря. При неоадъювантной лучевой терапии доза облучения, как правило, составляет 30 Гр (в течение 2 нед), реже используются более низкие (20 Гр в течение 1 нед) или более высокие (45—50 Гр) суммарные очаговые дозы. Лучевая терапия как самостоятельный метод лечения рака мочевого пузыря показана больным с низким риском прогрессирования: при папиллярных или пол-
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
ностью удаленных при ТУР опухолях, а также в отсутствие гидронефроза. Поскольку во множестве клинических испытаний доказаны преимущества комбинации химио- и лучевой терапии, в большинстве клиник она является методом выбора при органосохраняющем лечении рака мочевого пузыря.
Комбинация химио- и лучевой терапии
Эффективность комбинации химио- и лучевой терапии как органосохраняющего метода лечения при раке мочевого пузыря ранних стадий доказана несколькими авторами. При опухолях одинаковых стадий общая выживаемость после применения комбинации химио- и лучевой терапии и после радикальной цистэктомии примерно одинакова. Во II фазе клинических испытаний органосохраняющего лечения рака мочевого пузыря химио- и лучевая терапия была проведена 53 больным с опухолями Т2—4. После полной ТУР опухоли все больные получали 2 курса лечения комбинацией цисплатина, метотрексата и винбластина и лучевую терапию на область малого таза в суммарной очаговой дозе 40 Гр. Больным с полной ремиссией или противопоказаниями к операции назначался еще один курс химиотерапии цисплатином и проводилось облучение уменьшенного объема мишени в форме перевернутого конуса до суммарной очаговой дозы 68,4 Гр. При частичной ремиссии или неэффективности химио- и лучевой терапии выполнялась радикальная цистэктомия. Медиана периода наблюдения составила 2 года, безрецидивная выживаемость — 45%. Сохранить мочевой пузырь удалось более чем у 50% больных.
В больнице Эрлангенского университета проведено самое последнее из крупных клинических испытаний комплексного лечения рака мочевого пузыря. Пятилетняя общая выживаемость после него оказалась примерно такой же, как и после хирургического лечения. Основным прогностическим фактором оказался объем остаточной опухоли после ТУР. Пятилетняя общая выживаемость больных с полной ремиссией составила 81%, с микроскопической остаточной опухолью — 53%, явной остаточной опухолью — 31%. Многофакторный анализ, завершенный ранее в Массачусетском госпитале, показал, что полная ремиссия наиболее вероятна при опухолях ранних стадий без сопутствующего рака in situ. Во II фазе клинических испытаний Исследовательской группы по лучевой терапии злокачественных опухолей № 8802 (RTOG 8802) было показано, что комбинация химио- и лучевой терапии позволяет сохранить мочевой пузырь у многих больных раком мочевого пузыря, причем выживаемость после комплексного лечения такая же, как после радикальной цистэктомии (сравнение с ретроспективными данными). Однако в III фазе клинических испытаний Исследовательской группы по лучевой терапии злокачественных опухолей № 8903 (RTOG 8903) частота полных ремиссий и 5-летняя выживаемость после неоадъ-ювантной полихимиотерапии метотрексатом, цисплатином и винбластином и лучевой терапии оказались такими же, как после одновременного проведения лучевой
терапии и монохимиотерапии цисплатином. Трехлетняя выживаемость составляет 83%, с сохранным мочевым пузырем — 73%. Как следует из этих и других данных, у части больных раком мочевого пузыря эффективно одновременное проведение лучевой терапии I и химиотерапии на основе цисплатина. Неоадъювант- I ная полихимиотерапия не улучшает результаты лече- I ния. Риск рецидива ниже у больных с полной ремисси- I ей после первого этапа лечения. Это следует учитывать при отборе больных для органосохраняющего лечения, поскольку сохранение органа не должно ухудшать выживаемость.
Пред- и послеоперационная лучевая терапия
Эффективность неоадъювантной лучевой терапии при раке мочевого пузыря остается предметом дискуссий. Сравнению комбинированного лечения (неоадъювантной лучевой терапии и операции) и лучевой терапии посвящено несколько контролируемых клинических ис-пытаний. К сожалению, большинству из них присущи серьезные недостатки — небольшое число наблюдений, неправильные режимы лучевой терапии и неправильный отбор больных. Тем не менее ни в одном из них статистически значимого увеличения выживаемости после неоадъювантной лучевой терапии отмечено не было. Метаанализ результатов этих исследований все же выявил, что неоадъювантная лучевая терапия увеличивает 5-летнюю общую выживаемость на 10%.
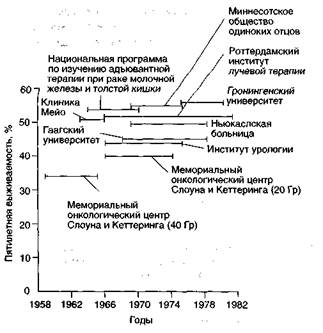
В одном из обзоров авторы приводят убедительные аргументы в пользу неоадъювантной лучевой терапии при раке мочевого пузыря. Они отмечают, что в большинстве контролируемых клинических испытаний комбинированного и хирургического лечения при оценке результатов лечения по стадиям сравнивали клинические (часто заниженные) и морфологические стадии и эта погрешность вполне могла скрыть преимущества I неоадъювантной лучевой терапии. Другой аргумент за- I ключается в том, что неоадъювантная лучевая терапия I снижает индекс Т у 75% и индексы Т и N — у 50% боль- I ных. Кроме того, в 30—40% случаев после неоадъювантной лучевой терапии при гистологическом исследовании I операционного материала опухоль не обнаруживают, В I итоге авторы приходят к выводу, что комбинированное I лечение (неоадъювантная лучевая терапия и радикальная цистэктомия) эффективнее хирургического. ПреЯ веденный анализ схематически изображен на рис. 28.7. В недавнем клиническом испытании, проведенном в Онкологическом центре М. Д. Андерсона, установлено, что у определенной категории больных неоадъювантная лучевая терапия, возможно, снижает риск рецидива, но общая выживаемость при этом не меняется.
Послеоперационную лучевую терапию при раке мочевого пузыря считают нецелесообразной, потому что, I судя по первому опыту, риск рецидива и осложнений после нее выше, чем после неоадъювантной. Сеймам этот метод лечения не представляет интереса для ис- I следователей.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
|

|
 Рисунок 28.7. Результаты неоадъювантной лучевой терапии при раке мочевого пузыря. Parsons JT, Million RR. Planned Preoperative Irradiation in the Management of Clinical Stage B2-C (T3) Bladder Carcinoma. Seminars in Surgical Oncology 1989; 5:255.
Рисунок 28.7. Результаты неоадъювантной лучевой терапии при раке мочевого пузыря. Parsons JT, Million RR. Planned Preoperative Irradiation in the Management of Clinical Stage B2-C (T3) Bladder Carcinoma. Seminars in Surgical Oncology 1989; 5:255.
 Контактная и интраоперационная лучевая
Контактная и интраоперационная лучевая
терапия
При раке мочевого пузыря ранних стадий можно проводить контактную лучевую терапию. Впервые в истории иглу из радия имплантировала в мочевой пузырь Б. Ван дер Верф- Мессинг. По ее данным, частота рецидивов через 5 лет при опухолях Т1 составляет 18%, при опухолях Т2 — 23%. Опыт интраоперационной лучевой терапии при раке мочевого пузыря невелик. В частности, после интраоперационной Р-терапии с последующей дистанционной у-терапией частота рецидивов при опухолях Т1-2 составляет 9%.
Осложнения
Ранние и поздние лучевые реакции обычно легкие. Среди ранних следует отметить понос и цистит. Тошнота нехарактерна. Хроническая боль в надлобковой области или дисфункция мочевого пузыря наблюдаются примерно у 10% больных. Основная причина дисфункции мочевого пузыря — уменьшение его емкости. После лучевой терапии в режиме HDR поздние лучевые повреждения прямой кишки (среднетяжелые и тяжелые) наблюдаются в 3-4% случаев, тонкой кишки — в 1—2%. Летальность i лучевой терапии как самостоятельного метода лечения рака мочевого пузыря составляет около 1%.
Герминогенные опухоли яичка
При семиноме яичка I стадии после орхифуникулэкто-мии почти во всех клиниках проводится облучение пояс-
ничных и ипсилатеральных тазовых лимфоузлов. На рис. 28.8 и 28.9 отражена частота поражения лимфоузлов при семиноме правого и левого яичка ранних стадий. Поскольку микрометастазы в лимфоузлы встречаются лишь у 15% больных, проведено несколько исследований, целью которых было установить, обязательна ли лучевая терапия при семиноме. Оказалось, что 5-летняя выживаемость, определяемая опухолью, составляет 97—99% и после адъювантной лучевой терапии, и без нее, поэтому наблюдение — вполне приемлемая тактика ведения больных семиномой яичка I стадии. На риск прогресси-рования влияют гистологический тип опухоли, прорастание белочной оболочки, инвазия сосудов, поражение семенного канатика и придатка яичка. По результатам многофакторного анализа, о высоком риске прогресси-рования при наблюдении свидетельствует только возраст больных на момент постановки диагноза моложе 34 лет и размер опухоли более 6 см.
По данным недавней публикации, суммирующей 15-летний опыт Королевской коллегии радиологов, частота прогрессирования при наблюдении статистически значимо выше, чем после лучевой терапии (15 и 4% соответственно, р < 0,05). Однако статистически значимых различий в выживаемости между группами нет. Следует отметить, что активное наблюдение в течение 5 лет без лечения обходится на 40% дороже, чем адъювантная лучевая терапия и наблюдение после нее. Активное наблюдение после операции подразумевает тщательное регулярное обследование, в том числе определение уровней опухолевых маркеров в сыворотке и КТ каждые 3—6 мес.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов

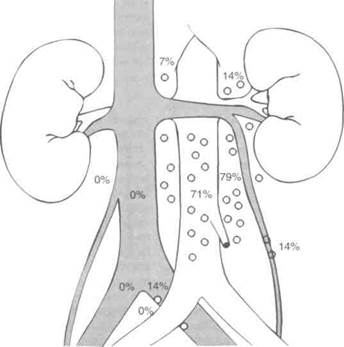
Рисунок 28.8. Частота и локализация поражения лимфоузлов при семиноме левого яичка ранних стадий. Donohue JP et al. Distribution of nodal nets in nonseminomatous testis cancer. J Urol 1982; 126:315.
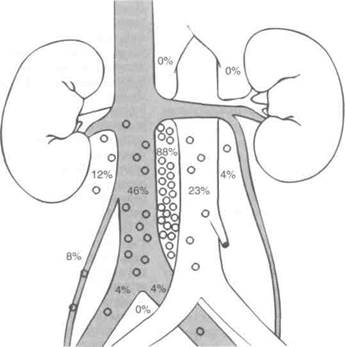
Рисунок 28.9. Частота и локализация поражения лимфоузлов при семиноме правого яичка ранних стадий. Donohue JP etal. Distribution of nodal nets in nonseminomatous testis cancer. J Urol 1982; 126:315.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
 JP et al.
JP et al.
JP et al.
Особенности клинического течения семиномы яичка определяют, что длительность наблюдения больных, не получавших лучевую терапию, должна составлять по крайней мере 10—15 лет. При этом нельзя забывать, что постоянное ожидание неприятных новостей наносит больному и психологический, и материальный ущерб.
Для излечения микроскопической остаточной опухоли достаточной считают суммарную очаговую дозу 25 Гр. Более высокие дозы на выживаемость, определяемую опухолью, не влияют, но повышают риск лучевого повреждения нормальных тканей.
При прогрессировании семиномы яичка опухоль чаще всего локализуется в забрюшинном пространстве и лишь в 0,5—3% случаев в малом тазу. Предварительные результаты одного из контролируемых клинических испытаний указывают, что облучение только поясничных лимфоузлов после орхифуникулэктомии может увеличить общую 5-летнюю выживаемость до 97%, а выживаемость, определяемую опухолью, — до 100%. Не исключено, что эти выводы подтвердятся после завершения кооперированного клинического испытания, проводимого Европейской организацией по исследованиям и лечению злокачественных опухолей, в котором сравнивают результаты облучения поясничных и поясничных и тазовых лимфоузлов при семиноме яичка.
Поскольку при семиноме яичка поздних стадий и прогрессировании эффективна монохимиотерапия, было предложено проводить адъювантную химиотерапию при семиноме яичка I стадии. В одном из клинических испытаний через 51 мес наблюдения у 99% больных рецидива не было. Однако из-за недостаточно длительного периода наблюдения, а также малого числа клинических испытаний рекомендовать такую тактику лечения для широкого применения пока нельзя.
Лучевую терапию при семиноме яичка II стадии про-водяттакже, как при опухолях I стадии. Частота рецидивов менее 5%, а 5-летняя выживаемость, определяемая опухолью, после полихимиотерапии на основе циспла-тина по поводу рецидива — 95—100%. При крупных (более 5 см) метастазах в забрюшинные лимфоузлы и мест-нораспространенных опухолях лечение следует начинать схимиотерапии. Частота рецидивов после химиотерапии может быть выше 35%, а 5-летняя выживаемость, определяемая опухолью, — 80—90%.
Профилактическое облучение надключичных лимфоузлов и лимфоузлов средостения большинство авторов не рекомендуют. На Международной согласительной конференции, прошедшей в 1989 г. в г. Лидс, облучение пахово-мошоночной области тоже сочли необязательным, даже при прорастании кожи мошонки. Особенности лучевой терапии семиномы яичка разных стадий приведены в табл. 28.12.
В нескольких клинических испытаниях доказано, что адъювантная лучевая терапия при несеминомных гер-миногенных опухолях яичка высокоэффективна и относительно безопасна. Облучение забрюшинного пространства снижает частоту прогрессирования, однако
15% больных с несеминомными герминогенными опухолями яичка I стадии, несмотря на это, в дальнейшем все-таки требуется химиотерапия в связи с поражением лимфоузлов другой локализации или внутренних органов. После химиотерапии 5-летняя выживаемость при низком и умеренном риске прогрессирования достигает 80—100%. На основании этих данных и с учетом того, что облучение расширенными полями затрудняет последующее проведение химиотерапии, профилактическая лучевая терапия при несеминомных герминоген-ных опухолях яичка сейчас не проводится.
Осложнения
Ранние лучевые реакции при облучении поясничных лимфоузлов в низких дозах проявляются легкой тошнотой, небольшой эритемой и преходящим нарушением сперматогенеза. Поздние лучевые реакции редки, но опасны. Это нарушение сперматогенеза в контралате-ральном яичке, вторичные злокачественные опухоли и поражения ЖКТ (язвы, геморрагический гастрит, кишечная непроходимость). У половины больных с семи-номой яичка сперматогенез в той или иной степени нарушен еще до лечения, поэтому оценить, как на этот процесс влияет лучевая терапия, можно лишь приблизительно. Значительное, хотя и преходящее снижение числа сперматозоидов бывает из-за рассеяния ионизирующего излучения с захватом второго яичка. Через 2—3 года после лечения фертильность, как правило, восстанавливается. Тщательное экранирование во время облучения позволяет снизить дозу, поглощенную вторым яичком, до 1—2% суммарной очаговой.
Риск тяжелого поражения ЖКТ прямо пропорционален суммарной очаговой дозе: при дозе ниже 25 Гр он
Таблица 28.12. Рекомендации по лучевой терапии при семиноме
| Частота реци- | |||
| дивов после | Рекомендуе- | ||
| дистанционной | мая суммар- | ||
| Метастазы в | лучевой тера- | Области облу- | ная очаговая |
| лимфоузлы | пии, % | чения | доза, Гр |
| Нет, или диа- | 2-4 | Поясничные | |
| метром мень- | лимфоузлы и | ||
| ше 2 см | ипсилатераль- | ||
| ные лимфоузлы | |||
| ворот почки | |||
| Диаметром | Поясничные и | 25-35 | |
| 2—5 см (не- | ипсилатераль- | ||
| пальпируе- | ные тазовые | ||
| мые) | лимфоузлы | ||
| Диаметром | Только химио- | ||
| 5-Юсм | терапия | ||
| Диаметром | Только химио- | ||
| более 10 см | терапия |
Rorth BJ et al. and the Danish Testicular Cancer Group. Surveillance alone versus radiotherapy after orchiectomy for clinical stage [ nonseminomatous testicular cancer. J Clin Oncol 1991; 9:1543.
Date: 2016-11-17; view: 338; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |