
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Общие принципы лучевой терапии 2 page
 Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов 465
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов 465
| Таблица 28.4. Отдаленные результаты дистанционной лучевой терапии при раке предстательной железы | ||||
| Доля больных с | Доля больных, у которых через 5 и 10 лет от- | |||
| нормальным | сутствуют клинические | 10-летняя выживае- | ||
| уровнем ПСА че- | признаки прогрессиро- | мость, определяемая | ||
| Авторы и характеристики больных | Число больных | рез 5 и 10 лет, % | вания, % | опухолью, % |
| Kaplan и соавт. (1993), Медицинский | 117а | — | — | — |
| центр Стэнфордского университета | ||||
| Т1 | 44 (38%) | 48/- | 75/- | — |
| Т2 | 35 (30%) | 60/- | 70/- | — |
| ТЗ-4 | 37(31%) | 15/- | 20/- | — |
| Stamey и соавт. (1993), Медицинская | ИЗ6 | -/20 | — | — |
| школа Стэнфордского университета | ||||
| Т1 | 14(12%) | -/43 | — | — |
| Т2 | 49 (43%) | -/20 | — | — |
| ТЗ | 33 (29%) | -/21 | — | — |
| N1 | 17(15%) | -/0 | — | — |
| Schellhammer и соавт. (1993), Медицин- | _____ В | — | — | |
| ская школа Университета Восточной | ||||
| Вирджинии | ||||
| Т1 | 40(13%) | 65/35 | 75/65 | — |
| Т2а | 29 (9%) | 42/20 | 60/40 | — |
| Т2Ь | 112(36%) | 50/20 | 60/35 | — |
| ТЗ | 130(42%) | 30/10 | 40/25 | — |
| Hanks и соавт. (1994), Онкологический | 39г | -/38 (-/26, | -/72 | — |
| центр Фокс-Чейз | если норма ПСА< 1,5нг/мл) | |||
| Tib | — | — | — | — |
| Т2а | — | — | — | — |
| Т2Ь | — | — | — | — |
| Hancock и соавт. (1994), Медицинская | 110д | — | — | — |
| школа Стэнфордского университета | ||||
| Т1 | — | -/72,2 | __ | — |
| Т2 | — | -/37,3 | — | — |
| ТЗ | — | -/28,1 | — | — |
| Т4 и N1 | — | -/11,1 | — | — |
| Zagars, Pollack (1995), Онкологический | ____ е | 87/70 | — | |
| центр М. Д. Андерсона | ||||
| Т1а | 18(7%) | — | — | — |
| Tib | 57(21%) | — | — | — |
| Tic | 47(18%) | — | — | — |
| Т2а | 42(16%) | — | — | — |
| T2b | 81 (30%) | — | — | — |
| Т2с | 24 (9%) | — | — | — |
| Kuban и соавт. (1995), Медицинская | ____ в | — | — | |
| школа Восточной Вирджинии | ||||
| Tib | 27 (7%) | 72/35 | 82/66 | |
| Т2а | 60(15%) | 63/18 | 79/57 | |
| Т2Ь-2с | 62(17%) | 60/21 | 73/48 | |
| ТЗ-4 | 246 (62%) | 34/11 | 47/29 | |
| Zietman и соавт. (1995), Массачусетская | _____ Ж | — | — | |
| больница | ||||
| Т1-2а | 220(21%) | 66/47 | — | — |
| Т2Ь—2с | 284 (27%) | 51/29 | — | — |
| ТЗ-4 | 540 (52%) | 42/18 | — | — |
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
Таблица 28.4 (окончание). Отдаленные результаты дистанционной лучевой терапии при раке предстательной железы
| Доля больных с | Доля больных, у которых через 5 и 10 лет от- | |||
| нормальным уров- | сутствуют клинические | 10-летняя выживае- | ||
| нем ПСА через 5 и | признаки прогрессиро- | мость, определяемая | ||
| Авторы и характеристики больных | Число больных | Шлет, % | вания, % | опухолью, % |
| Roach и соавт. (1996а) | 490а | — | — | — |
| Tib—1с | 90(18%) | 60/- | — | |
| Т2 | 272 (56%) | 50/- | — | - |
| ТЗ-4 | 128 (26%) | 30/- | — | - |
(—) — не известно.
"Через 4 года.
6 Средняя длительность наблюдения 9 лет.
в Норма ПСА < 4 нг/мл.
гДлительность наблюдения 9—13 лет, наблюдение продолжается.
д Средняя длительность наблюдения 12,4 года.
'Уровень ПСА не оценивался.
ж Норма ПСА < 1 нг/мл.
Roach M, Wallner К: Prostate cancer. In: Leibel SA, Phillips TL (eds): Textbook of Radiation Oncology. Saunders, 1998.
4-я группы). Синергизм действия ионизирующего излучения и полной андрогенной блокады объясняется, вероятно, ускорением апоптоза, хотя возможен и за счет разных механизмов. Не исключено, что это ускоряет гибель клеток в неоднородных опухолях, состоящих из гормонально-зависимых и гормонально-независимых клеток. Таким образом, становится понятно, почему комбинация гормональной и лучевой терапии эффективна не у всех больных.
Трехмерная конформная лучевая терапия
Некоторые причины рецидивов, подробно перечисленные в табл. 28.6, в ряде клиник устранили, используя при планировании лучевой терапии КТ для трехмерной реконструкции малого таза. Трехмерная конформная лучевая терапия — сложнейший способ подведения высоких
доз ионизирующего излучения к объему мишени при гораздо более щадящем по сравнению со стандартной лучевой терапией отношении к нормальным тканям. На рис. 28.3 представлены поля облучения и объем мишени при трехмерной конформной лучевой терапии по поводу рака предстательной железы, на рис. 28.4 — трехмерная реконструкция объема мишени при облучении с левого бокового поля, на рис. 28.5 — изодозные кривые, наложенные на томограммы в сагиттальной и горизонтальной плоскостях, при облучении с 7 полей. На рис. 28,6 представлены кривые «доза—объем», наглядно демонся рирующие достоинства трехмерной конформной лучевой терапии. По сравнению со стандартной лучевой терапией (с 4 противолежащих полей с добавлением ротации) при трехмерной конформной лучевой терапии доза, погш щенная 50% объема прямой кишки, снижается на 30%,
Таблица 28.5. Результаты хирургического лечения и дистанционной лучевой терапии при раке предстательной железы в зависимости от уровня ПСАа
| Уровень лечения, | ПСА до нг/мл | Больные, которым проводилось хирургическое лечение6, % | Больные которым проводилась лучевая терапия6, % | 5-летняя выживаемость после хирургического лечения6, % | 5-летняя выживаемость после лучевой терапии', % | ||||||
| 0-4 | 26(15- | -43) | 21 (11- | -33) | 85- | -95 | 80- | -86 | |||
| 4,1- | 41 (35- | -52) | 30 (27- | -32) | 55- | -93 | 42- | -67 | |||
| 10,1- | -20 | 26(16- | -32) | 21 (18- | -22) | 30- | -75 | ||||
| >20 | 13(6- | 20) | 35(18- | -50) | - |
У больных, которым проводилось хирургическое лечение, лимфоузлы, как правило, были не поражены, а опухоли были более высо-1 кодифференцированными и более ранних стадий, чем у больных, которым проводилась лучевая терапия. Указаны средние значения,! в скобках — диапазон.
В большинстве исследований исключены больные с поражением лимфоузлов и повышением уровня ПСА после лечения более 0,2-0,6 нг/мл.
8 Включены только больные с поражением лимфоузлов, опухолями ТЗ—4 и повышенным более 1,0—4,0 нг/мл или нарастающим урон нем ПСА после лечения. Roach M, Wallner К: Prostate cancer. In: Leibel SA, Phillips TL (eds): Textbook of Radiation Oncology. Saunders, 1998.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
 Таблица 28.6. Причины неэффективности стандартной лучевой терапии и профилактика рецидивов рака предстательной железы
Таблица 28.6. Причины неэффективности стандартной лучевой терапии и профилактика рецидивов рака предстательной железы
Причины рецидивов
1. Неправильное определение объема мишени:
а) размеры полей слишком малы, или их нижняя граница
находится слишком высоко;
б) в поля облучения не входят семенные пузырьки
2. Низкая суммарная очаговая доза:
а) мнение о том, что облучение в суммарной очаговой до
зе 65—70 Гр достаточно для излечения;
б) запланированная доза не подведена из-за технических
трудностей или лучевых реакций со стороны нормаль
ных тканей
3. Занижение стадии (невыявленная диссеминация)
Профилактика рецидивов
1, Правильное определение объема мишени: планирование полей с помощью трехмерной реконструкции объема мишени по КТ и ретроградным цистоуретрограммам (трехмерная конформная лучевая терапия)
2, Подведение достаточной суммарной очаговой дозы
3, Более точное определение стадии, определение уровня ПСА и индекса Глисона до лечения
Ввиду явных преимуществ трехмерную конформную лучевую терапию уже считают стандартным методом лечения рака предстательной железы во многих крупных клиниках. Поскольку при этой методике нормальные пани получают меньшую дозу ионизирующего излучения, снижается и риск лучевых повреждений, что представляет собой еще одно преимущество трехмерной кон-
формной лучевой терапии. Это позволит повысить суммарную очаговую дозу и, возможно, эффективность лечения. По данным Онкологического центра Фокс-Чейз, Калифорнийского университета (Сан-Франциско), Мемориального онкологического центра Слоуна и Кеттеринга и Онкологического центра М. Д. Андерсона, увеличение суммарной очаговой дозы чаще сопровождается нормализацией уровня ПСА в сыворотке (табл. 28.9). Судя по первым результатам, повышение суммарной очаговой дозы на ] 0% позволит снизить частоту рецидивов на 20%.
Максимальная поглощенная доза ионизирующего излучения зависит от его переносимости нормальными тканями. В табл. 28.10 приведены данные нескольких проведенных недавно контролируемых клинических испытаний, в которых было изучено повышение суммарной очаговой дозы при дистанционной лучевой терапии по поводу рака предстательной железы. В двух из них не было получено различий в частоте ранних лучевых реакций после трехмерной конформной и стандартной лучевой терапии. Что особенно важно, в отдаленные сроки после трехмерной конформной лучевой терапии реже наблюдался лучевой проктит. В клиническом испытании, проведенном в Онкологическим центре М. Д. Андерсона, при трехмерной конформной лучевой терапии суммарную очаговую дозу повышали до 78 Гр, при стандартной лучевой терапии она составляла 70 Гр. Статистически значимых различий в частоте рецидивов и общей выживаемости отмечено не было, однако длительность наблюдения за больными в этом исследовании слишком мала. В настоящее время Исследовательская группа по лучевой терапии злокачественных


Рисунок 28.3.Трехмерная конформная лучевая терапия при раке предстательной железы (облучение с 7 полей). А. Разметка по-кй на коже. Б. Контрольная томограмма для уточнения положения головок бедренных костей и лобкового симфиза. Непрерыв-войлинией обведены предстательная железа и семенные пузырьки.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов

Рисунок 28.4.Трехмерная реконструкция контуров прямой кишки, предстательной железы, семенных пузырьков и луковицы полового члена в левой боковой проекции.
опухолей проводит I и II фазу клинических испытаний трехмерной конформной лучевой терапии при раке предстательной железы. Их цель — установить максимальную суммарную очаговую дозу ионизирующего из-
лучения, которую можно подвести с помощью данной методики. По предварительным данным, при сравнении с ретроспективными результатами стандартной лучевой терапии трехмерная конформная лучевая терапш! позволяет довести суммарную очаговую дозу до 80 Гр при более низкой частоте поздних лучевых реакций.
Контактная лучевая терапия
Место стандартной дистанционной лучевой терапия при раке предстательной железы постепенно занимают! другие методы. Один из них — контактная лучевая тера-1 пия. Ее главное преимущество —- возможность подведения очень высокой дозы ионизирующего излучения к ограниченному объему и сокращение длительности лу-1 чевой терапии. Современные методы лучевой диагностики обеспечивают контроль во время имплантации источников ионизирующего излучения, тем самым избавляя больного от операции. В недавних клинически испытаниях введение источников ионизирующего излучения контролировали с помощью КТ и УЗИ ректальным датчиком. Трансректальное введение источников ионизирующего излучения под контролем УЗИ было впервые применено в 1980 г. в Северо-Западном онкологическом институте. При этом частота импотенции и лучевого повреждения мочевых путей оказалась ниже, а стоимость лечения меньше, чем открытой имплантации источников, не говоря уже об удобстве этой методики для больных. Постоянные источники ионизирующего излучения используются, как правило, га лучевой терапии в режиме LDR и подведения более высокой суммарной очаговой дозы. На рис. 28.1 представлено внутритканевое распределение |251, имплантиро-

|

|
Рисунок28.5. Изодозные кривые, наложенные на томограммы го трехмерную конформную лучевую терапию (облучение с 7 п< ные кривые в горизонтальной плоскости.
малого таза больного раком предстательной железы, получающе-шей). А. Изодозные кривые в сагиттальной плоскости. Б. Из»
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов

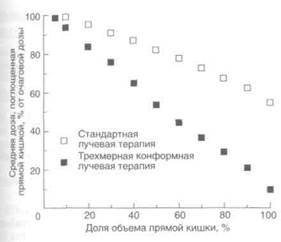
Рисунок 28.6. Кривые «доза—объем» для прямой кишки при стандартной (облучение с 4 противолежащих полей с добавлением двухосевой ротации с углом качания 120°) и трехмерной конформной лучевой терапии (облучение с 6 полей с частичной защитой блоками) при раке предстательной железы.
ванного в предстательную железу под контролем УЗИ ректальным датчиком.
Из старых публикаций следует, что внутритканевая лучевая терапия с использованием постоянных источников ионизирующего излучения менее эффективна, чем дистанционная. В более поздних работах показано, что результаты лечения можно улучшить, проводя имплантацию под контролем УЗИ ректальным датчиком или КГ. В табл. 28.11 представлены результаты 5 клинических испытаний, в которых сравнивали результаты внутритканевой и дистанционной лучевой терапии, а также комбинированного лечения рака предстательной железы. В 4 из них у больных с низким риском смерти от рака предстательной железы (Т1— 2а, уровень ПСА не более 10 нг/мл, индекс Глисона не более 6) результаты внутритканевой и дистанционной лучевой терапии статистически значимо не отличались. Однако у больных с
умеренным и высоким риском смерти от рака предстательной железы (уровень ПСА более 10 нг/мл, индекс Глисона более 7) и радикальная простатэктомия, и дистанционная лучевая терапия оказались эффективнее внутритканевой лучевой терапии. В одном из этих клинических испытаний внутритканевая лучевая терапия оказалась эффективнее дистанционной. Однако у всех больных, получавших дистанционную лучевую терапию, был высокий риск смерти от рака предстательной железы, а суммарная очаговая доза составила только 66 Гр.
В настоящее время в Калифорнийском университете (Сан-Франциско) и большинстве крупных клиник при умеренном и высоком риске смерти от рака предстательной железы (3-я и 4-я группа, табл. 28.7) дистанционную лучевую терапию сочетают с внутритканевой. Преимущества этой тактики подтверждены в ретроспективном исследовании — результаты сочетанной лучевой терапии у больных с крайне высоким риском, определенным по индексу Глисона, уровню ПСА и индексу Т, оказались несколько лучше, чем результаты внутритканевой лучевой терапии. Казалось бы, увеличение риска смерти от рака предстательной железы должно ухудшать результаты лечения. Тем не менее была отмечена тенденция к повышению 10-летней безрецидивной выживаемости у больных 2-й группы по сравнению с больными 1-й группы риска (р = 0,09). Общая выживаемость в обеих группах статистически значимо не отличалась. Сторонники контактной лучевой терапии при раке предстательной железы утверждают, что внутритканевая лучевая терапия вызывает меньше осложнений, чем трехмерная конформная. Однако результаты клинического испытания, проведенного в Мемориальном онкологическом центре Слоуна и Кеттеринга, заставили усомниться в этом.
Таким образом, внутритканевая лучевая терапия как самостоятельный метод лечения показана больным с низким риском смерти от рака предстательной железы, когда опухоль ограничена предстательной железой или имеется очаговое прорастание капсулы. Из-за быстрого падения мощности дозы при высоком риске смерти от

Габлица 28.7. Выживаемость, определяемая опухолью, в зависимости от риска смерти от рака предстательной келезы у больных, получавших только лучевую терапию (контролируемые клинические испытания Исследова-гельской группы по лучевой терапии злокачественных опухолей, 1975—1992 гг.)
| Число смертей/общее | 5-летняя выживаемость6, | 10-летняя выживаемость6. | 15-летняя выживаемость6, | |
| Группа риска" | число больных | % | % | % |
| 63/474 | 97 (95-99) | 85(81-89) | 71 (61-81) | |
| 69/335 | 91 (88-94) | 75(69-81) | 59 (49-69) | |
| 89/336 | 82 (78-86) | 60 (52-68) | 38(21-55) | |
| 138/314 | 66 (60-72) | 34 (26-42) | 28(19-37) |
'Группа 1 — индекс Глисона, равный 2—5, при любом Т или индекс Глисона, равный 6, и Т1— 2Nx. Группа 2 — индекс Глисона, равный 6, иТЗНхилиТлюбойМ1 или индекс Глисона, равный 7, иТ1—2Nx. Группа 3 — индекс Глисона, равный 7, и Т3№или ТлюбойМ или индекс Глисона, равный 8—10, иТ1—2Nx. Группа 4 — индекс Глисона, равный 8—10, иТЗШили ТлюбойТЧК 6Вскобках указан 95% доверительный интервал.
Roach M et al.: Prognostic subgroups predict disease specific survival for men treated with radiotherapy alone on radiation therapy oncology group (RTOG) prostate cancer trials. Proceedings of the American Society of Clinical Oncology, 34th Annual Meeting. Proceedings of the American Society for Clinical Oncology 1998; 17:312a.
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
Таблица 28.8. Эффективность дистанционной лучевой терапии с полной андрогенной блокадой и без нее приг. ке предстательной железы
А вторы
Исследование
Результаты
 Pilepich и соавт. (1998)
Pilepich и соавт. (1998)
Laverdiere и соавт. (1997)
Bella и соавт. (1997)
Дистанционная лучевая терапия по сравнению с дистанционной лучевой терапией и полной андрогенной блокадой за 2 мес до и во время лучевой терапии
Дистанционная лучевая терапия по сравнению с дистанционной лучевой терапией и неоадъювант-ной гормональной терапией (полная андрогенная блокада в течение 3 мес) по сравнению с дистанционной лучевой терапией, неоадъювантной (3 мес) и адъювантной гормональной терапией (10,5 мес) Дистанционная лучевая терапия по сравнению с дистанционной лучевой терапией, неоадъювантной (аналоги гонадолиберина, 1 мес) и адъювантной (3 года) гормональной терапией"
Наблюдение в течение 8 лет. Частота излечения первичной опухоли 51 и 63% соответственно (р = 0,002), Частота метастазов 48 и 34% (р = 0,03). Доля больньи без признаков прогрессирования 23 и 35% (р < 0,002). Общая выживаемость 43 и 51% (р = 0,22) Частота выявления опухоли при биопсии через 2 года после лечения: 65, 30 и 5% соответственно. Период наблюдения слишком короток для оценки выживаемости
Частота излечения первичной опухоли — 77 и 97% соответственно (р < 0,001). Безрецидивная выживаемость 48 и 85% (р < 0,001). Общая выживаемость62и 79% (р = 0,001)
а III фаза клинических испытаний, проводимых Европейской организацией по исследованиям и лечению злокачественных опухолей.
рака предстательной железы или местнораспространен-ной опухоли внутритканевую лучевую терапию лучше сочетать с дистанционной. Это позволяет воздействовать на микрометастазы.
Растет интерес к временным высокодозным источникам ионизирующего излучения для внутритканевой лучевой терапии. Преимущество временных источников ионизирующего излучения — снижение лучевой нагрузки на медицинский персонал и возможность коррекции неправильно расположенного источника. Хотя применение временных источников ионизирующего излучения может оказаться более эффективным, в целом оно чаще сопровождается осложнениями и требует госпитализации на период лечения. 1921г — единственный радио-
активный изотоп, применяемый в качестве временного источника для внутритканевой лучевой терапии при раке предстательной железы. Делать окончательные выводыо достоинствах высокодозных источников ионизирующего излучения из-за малого числа больных и недостаточной длительности наблюдения пока рано. Тем не менее есть основания полагать, что в руках опытных специалистов этот метод может по показаниям применяться при раке предстательной железы.
Применение нейтронов, протонов и тяжелых заряженных частиц
Считается, что противоопухолевое действие ионизирующего излучения дозозависимо. К сожалению, после
Таблица 28.9. Ретроспективные исследования эффективности различных доз дистанционной лучевой терапии при раке предстательной железы
Авторы
Исследование
Характеристики больных Примечания
Hanks (1996) Ретроспективное исследование, про-
веденное Онкологическим центром Фокс-Чейз
Roach (1996) Ретроспективное исследование,
50 больных
Zelefsky (1998) Ретроспективное исследование, проведенное Мемориальным онкологическим центром Слоуна и Кеттеринга
Pollack (1997) Ретроспективное исследование, проведенное Онкологическим центром М. Д. Андерсона
Fiveash (1998) Кооперированное ретроспективное исследование
Lyons (1998) Ретроспективное исследование, про-
веденное Кливлендской клиникой
Уровень ПСА > 10 нг/мл
Индекс Глисона 8— 10
Все группы риска смерти от рака предстательной железы
Все больные
Индекс Глисона 8—10
Все больные
Трехмерная конформная лучевая терапия с 4 полей
Результаты лучше при суммарной очаговой дозе более 71,5 Гр Увеличение суммарной очаговой дозы повышало эффективность лечения больных с умеренным и высоким риском смерти от рака предстательной железы Результаты лучше при суммарной очаговой дозе более 67 Гр
Увеличение суммарной очаговой дозы повышало эффективность лечения при опухолях Т1—2
Результаты лучше при суммарной очаговой дозе более 71,5 Гр
Глава 28. Лучевая терапия злокачественных опухолей мочевых путей и половых органов
 Таблица 28.10. Результаты контролируемых клинических испытаний трехмерной конформной лучевой терапии при раке предстательной железы
Таблица 28.10. Результаты контролируемых клинических испытаний трехмерной конформной лучевой терапии при раке предстательной железы
Авторы
Клиника
Исследование
_Рез^штзты_
Pollack (1996) Онкологический центр М. Д. Ан- III фаза
дерсона
Nguyen (1998) Онкологический центр М. Д. Ан- III фаза
дерсона
Tait (1997) Марсденский Королевский гос- III фаза
питаль
Dearnaley (1999) Марсденский Королевский roc- III фаза
питаль
Zelefsky (1998) Мемориальный онкологический I—II фаза (повышение
центр Слоуна и Кеттеринга суммарной очаговой дозы)
Michalski (1998) Исследовательская группа по лу- Кооперированное,
чевой терапии злокачественных I—II фаза (повышение
опухолей суммарной очаговой дозы)
Различий в частоте ранних лучевых реакций нет
Уменьшение частоты поздних лучевых реакций
Различий в частоте ранних лучевых реакций нет
Снижение частоты позднего лучевого проктита
При сравнении с ретроспективными данными переносимость высоких суммарных очаговых доз лучше
При сравнении с ретроспективными данными переносимость высоких суммарных очаговых доз лучше
 какой дозы ее повышение уже не усиливает противоопухолевый эффект, не известно. Трехмерная конформная лучевая терапия преследует три взаимосвязанных цели: 1) более точное подведение ионизирующего излучения к объему мишени, 2) безопасное подведение высоких доз ионизирующего излучения и 3) уменьшение лучевого повреждения нормальных тканей при высоко-дозном облучении. Альтернативу дистанционной лучевой терапии (традиционно у -терапии) представляет об-
какой дозы ее повышение уже не усиливает противоопухолевый эффект, не известно. Трехмерная конформная лучевая терапия преследует три взаимосвязанных цели: 1) более точное подведение ионизирующего излучения к объему мишени, 2) безопасное подведение высоких доз ионизирующего излучения и 3) уменьшение лучевого повреждения нормальных тканей при высоко-дозном облучении. Альтернативу дистанционной лучевой терапии (традиционно у -терапии) представляет об-
Date: 2016-11-17; view: 354; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |