
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Классы неорганических соединений
Химические вещества могут быть простыми и сложными. Среди простых веществ выделяют металлы и неметаллы (см. далее). Граница между металлами и неметаллами размыта, выделенные элементы проявляют двойственность свойств.
| (H) | Металлы Неметаллы | H | He | ||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La* | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac** | Ku |
La* – первый элемент семейства лантаноидов (14 лантаноидов),
Ас** – первый элемент семейства актиноидов (14 актиноидов).
Сложные неорганические соединения делят на три основных класса – оксиды, гидроксиды и соли.
Оксиды
| Оксиды – соединения элементов с кислородом. |
Если элементы проявляют переменную с.о., то образуют оксиды различного состава, что учитывают в названии оксида указанием с.о. элемента. Если элемент образует один оксид, то в названии оксида с.о. не указывают.
Например, Al2O3 – оксид алюминия (алюминий проявляет единственную с. о., равную +3); N2O3 – оксид азота (III) (азот проявляет различные с. о., в данном оксиде с. о. азота равна +3).
| Оксиды делят на несолеобразующие и солеобразующие. |
Несолеобразующие оксиды весьма немногочисленны – например CO, NO, N2O.
| Солеобразующие оксиды по химическим свойствам делят на три группы – основные, кислотные и амфотерные. |
Основные оксиды образуют только типичные металлы в степени окисления +1, +2 (не всегда), +3 (редко).
Кислотные оксиды образуют неметаллы, а также металлы в высоких степенях окисления (+6, +7). Оксиды неметаллов ‑ SO2, P2O5, оксиды металлов – 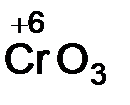 ,
,  .
.
Амфотерные оксиды образуют металлы в степени окисления +3, +4, +5, иногда +2, а также элементы, расположенные вблизи условной диагонали, разделяющей металлы и неметаллы (As ‑ As2O3, Sb ‑ Sb2O3). Амфотерные оксиды некоторых металлов в степени окисления +2 –ZnO, PbO, SnO, BeO – полезно запомнить. Амфотерные оксиды сочетают свойства основных и кислотных оксидов.
Date: 2015-05-22; view: 666; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |