
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тепловой эффект химических реакций. Термохимические расчеты
Любая химическая реакция сопровождается выделением или поглощением энергии обычно в виде теплоты. Раздел химической термодинамики, изучающий тепловые эффекты химических процессов, называется термохимией. Тепловые эффекты реакций можно определить как экспериментально, так и с помощью термохимичеких расчетов.
Тепловым эффектом химической реакции называется количество теплоты, выделенное или поглощенное в результате химического взаимодействия. Реакции, сопровождающиеся выделением теплоты, называются экзотермическими, а реакции, сопровождающиеся поглощением теплоты – эндотермическими.
Подавляющее большинство химических реакций – изобарные процессы. Поэтому целесообразно оценивать энергетический или тепловой эффект реакции изменением энтальпии системы. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы Qp = Δ H.
В экзотермических реакциях теплота выделяется в окружающее пространство, энтальпия или внутренняя энергия системы уменьшается и значения Δ H и ΔU для них отрицательны (ΔН<0, ΔU<0). В эндотермических реакциях теплота поглощается из окружающего пространства, энергосодержание системы увеличивается и изменения Δ H и ΔU положительны (ΔН >0, ΔU>0).
Уравнения химических реакций, в которых указаны тепловые эффекты и агрегатные состояния веществ называют термохимическими уравнениями. В термохимических уравнениях указывается также фазовое состояние и полиморфная модификация реагирующих и образующихся веществ: (г) – газовое, (ж) – жидкое, (к) – кристаллическое, (т) – твердое, (р) – растворенное и др.
Например, термохимическое уравнение синтеза воды имеет вид:
2Н2 (г) + О2 (г) = 2Н2О (ж); ΔH0298 = -571,6 кДж
из уравнения следует, что реакция является экзотермической (ΔН<0) и при взаимодействии 2 моль водорода и 1 моль кислорода образуется 2 моль воды и выделяется 571,6 кДж теплоты.
По термохимическим уравнениям реакций можно проводить различные расчеты. Для решения задач по термохимическим уравнениям нужно записать уравнение протекающей реакции. Затем на основе данных составить пропорцию и решить ее.
Пример 1. Вычислите по термохимическому уравнению
4Р(к) + 5О2(г) = 2Р2О5(к); Δ H= –3010кДж
количество телоты, выделяемой при сгорании 6,2 г фосфора.
Решение: Рассчитаем количество вещества фосфора
n(P) = m(P)/M(P) = 6,2/31 = 0,2 моль
Составим пропорцию и найдем количество теплоты:
при сгорании 4 моль Р - выделяется 3010 кДж теплоты
при сгорании 0,2 моль Р - выделяется X кДж теплоты
4/0,2 = 3010/ X; X = (0,2·3010)/4 = 150,5 кДж
Пример 2. Составьте термохимическое уравнение реакции горения магния, если известно, что при сгорании 6 г магния выделилось 153,6 кДж теплоты.
Решение. Рассчитаем количество вещества сгоревшего магния
n(Mg) = m(Mg)/M(Mg) = 6/24 = 0,25 моль
Составим уравнение реакции горения
2Mg(т) + O2 (г) =2MgO(т)
найдем количество теплоты, которое выделяется при сгорании 2 моль.
при сгорании 0,25 моль магния - выделяется 153,6 кДж
при сгорании 2 моль магния - выделяется X кДж теплоты
0,25/2 = 153,6/ X; X = (2·153,6)/0,254 = 1228,8 кДж
Следовательно, термохимическое уравнение реакции имеет вид:
2Mg(т) + O2 (г) =2MgO(т); Δ H= –1228,8 кДж
Пример 3. По термохимическому уравнению
С(т) + О2(г) = СО2(г); Δ H = – 394 кДж
Определите, сколько л оксида углерода (IV) (н.у.) образуется, если выделяется 591 кДж теплоты?
Решение. Рассчитаем, при образовании какого количества оксида углерода (IV) выделяется 591 кДж теплоты. Исходя из уравнения реакции составим пропорцию:
При образовании 1 моль СО2(н.у.) выделяется 394 кДж теплоты
При образовании X моль СО2(н.у.) выделяется 591 кДж теплоты
1/ X = 394/591; X = 591/394 = 1,5 моль СО2(н.у.)
По следствию из закона Авогадро: 1 моль любого газа (при н.у.) занимает объем 22,4 л составляем пропорцию:
1 моль СО2(н.у.) занимает объем 22,4 л
1,5 моль СО2(н.у.) занимают X л
1/1,5 = 22,4/ X; X = 1,5·22,4/1 = 33,6 л
Для того, чтобы можно было сравнить тепловые эффекты различных процессов термохимические расчеты обычно относят к 1 моль вещества и к стандартным состояниям и стандартным условиям. За стандартные условия приняты: давление 101 325 Па и температура 250С (298К). Стандартным состоянием вещества является состояние, устойчивое при стандартных условиях. Тепловой эффект при стандартных условиях называется стандартным тепловым эффектом реакции и обозначается ΔH0298 или ΔH0.
Основным законом термохимии является закон Г.И.Гесса (1841): тепловой эффект химического процесса зависит только от начального и конечного состояния веществ и не зависит от пути процесса, т.е. числа и характера промежуточных стадий.
Так, процесс превращения исходных веществ (состояние 1) в продукты (состояние 2) может быть осуществлен несколькими путями:
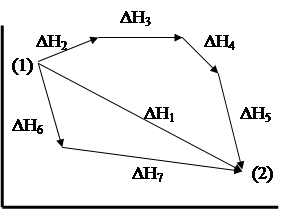 |
ΔH
время
Рис.2. Изменение энтальпии реакции с течением времени
По закону Гесса тепловой эффект процесса может быть рассчитан:
ΔH1 = ΔH2 + ΔH3 + ΔH4 + ΔH5 = ΔH6 + ΔH7
Согласно следствию из закона Гесса: тепловой эффект (энтальпия) реакции реакции равен разности суммы энтальпий образования продуктов реакции и суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
ΔH0 = ∑ΔH0f прод - ∑ ΔH f исх.в-в
Для расчета теплового эффекта реакции используют энтальпии (теплоты) образования веществ. Энтальпией образования называется тепловой эффект реакции образования 1 моль вещества из простых веществ. Стандартные энтальпии образования обозначают ΔH0обр, 298 или ΔH0f,298. Индекс f соответствует formation – образование. Часто один их индексов опускают. Стандартные энтальпии образования простых веществ, устойчивых в стандартных условиях (газообразный кислород O2 (г), жидкий бром Br2(ж), кристаллический иод J2(к), ромбическая сера S(р), графит C (графит) и т.д.) равны нулю.
Стандартной энтальпией образования называется изменение энтальпии в реакции образования 1 моль химического соединения из простых веществ, измеренное в стандартных условиях.
С помощью термохимических расчетов можно определить тепловой эффект реакций, энергию химических связей, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения и сольватации (гидратации), энергетические эффекты фазовых превращений и т.д.
Значения стандартных энтальпий образования ряда веществ приведены в Приложении 1.
Пример 2.1. На основаниизначений стандартной энтальпии образования вычислить тепловой эффект реакции, сделать вывод, экзотермической или эндотермической она является:
Сu2S (к) + 2 O2 (г) = 2 CuO (к) + SO2 (г)
Решение. Выпишем из Приложения 1 значения стандартных энтальпий образования веществ
Соединение………… Cu2S (к) O2 (г) CuO (к) SO2 (г)
ΔH0f , кДж/моль……..-82,01 0 -165,3 -296,9
Согласно следствию из закона Гесса:
ΔH0 = (2 ΔH0f, CuO (к) + ΔH0f, SO2 (г)) - (ΔH0f, Cu2S (к) + 2 ΔH0f, O2 (г)) =
= [2(-165,3) + (-296,9)] – [ (-82,01) + 2·0] = -545,5 кДж
Так как ΔH0 < 0, следовательно, реакция экзотермическая, сопровождается выделением 545,5 кДж тепла.
Пример 2.2. Рассчитать тепловой эффект реакции взаимодействия кристаллического оксида алюминия и газообразного оксида серы (IV).
Al2O3 (к) + 3 SO3 (г) = Al2(SO4)3 (к)
Решение. Выпишем из Приложения 1 значения стандартных энтальпий образования веществ
Соединение…………….. Al2O3 (к) SO3 (г) Al2(SO4)3 (к)
ΔH0f , кДж/моль………….-1676,0 -396,1 -3442,2
Тепловой эффект реакции в стандартных условиях определяется:
ΔH0 = ΔH0f, Al2(SO4)3 (к) – (ΔH0f, Al2O3 (к) + 3 ΔH0f, SO3 (г)) =
= (-3442,2) – [(1676,0 + 3(-396,1)] = -577,9 кДж
Так как ΔH0 < 0, следовательно, реакция экзотермическая, сопровождается выделением -577,9 кДж энергии.
Пример 2.3. Рассчитать тепловой эффект реакции образования сероуглерода CS2 и паров воды из газообразных сероводорода и оксида углерода (IV).
2H2S (г) + CO2 (г) = CS2 (г) + 2H2O (г)
Решение. Выпишем из Приложения 1 значения стандартных энтальпий образования веществ
Соединение…………….. H2S (г) CO2 (г) CS2 (г) H2O (г)
ΔH0f , кДж/моль…………. -20,15 -393,51 115,28 -241,88
Тепловой эффект реакции в стандартных условиях определяется:
ΔH0 = [ ΔH0f, CS2 (г) + 2 ΔH0f, H2O (г)] – [ 2 ΔH0f, H2S (г) + ΔH0f, CO2 (г) ]=
= [115?28 +2(-241,88)] – [2(-20,15) + (-393,51)] = +65,33 кДж
Тепловой эффект реакции составляет ΔH0 = +65,33 кДж, так как ΔH0 > 0, следовательно, реакция эндотермическая, протекает с поглощением тепла.
Пример 2.4. Определить тепловой эффект растворения КОН.
КОН (к) = К+(р) + ОН-(р)
Решение. Выпишем из Приложения 1 значения стандартных энтальпий образования веществ
Соединение………КОН (к) К+(р) ОН-(р)
ΔH0f , кДж/моль…..-425,8 -251,2 -230,2
ΔH0раств. = [(-251,2) + (230,2)] – (-425,8) = -55,6 кДж
Процесс растворения щелочи экзотермический, сопровождается выделением -55,6 кДж.
Пример 2.5. Определитетепловой эффект фазового перехода:
SO3 (ж) = SO3 (г)
Решение: Выпишем из Приложения 1 значения стандартных энтальпий образования.
Соединение…………. SO3 (ж) SO3 (г)
ΔH0f , кДж/моль…….. -439,0 -396,1
Тепловой эффект фазового перехода рассчитывается по уравнению:
ΔH0исп. = (ΔH0f , SO3 (г)) – (ΔH0f , SO3 (ж) ) = (-396,1) – (-439,0) = 42,9 кДж
Процесс испарения оксида серы (VI) эндотермический, требует затраты энергии в 42,9 кДж.
Date: 2015-05-09; view: 2500; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |