
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Установление показателя политропы по опытным данным
Все, что было изложено ранее относительно политропных процессов, применимо к идеальным газам с постоянной изохорной теплоемкостью – сv. Для реальных газов изохорная теплоемкость величина переменная, следовательно, политропному процессу реального газа, отвечающему соотношению du/dq=a=const, будет соответствовать переменная теплоемкость с=сv/a. Переменная величина теплоемкости политропного процесса реального газа приводит к сложным зависимостям между термическими и энергетическими параметрами газа в таких процессах. Однако с достаточной для технических расчетов степенью точности для реальных газов можно использовать большинство полученных ранее формул для политропного процесса идеального газа [8], понимая при этом под политропным процессом реального газа процесс, удовлетворяющий уравнению
Pvn=const.
Величина показателя политропы n считается постоянной. Для уменьшения погрешности расчетов изохорную теплоемкость сv берут как среднюю cvm в интервале температур рассматриваемого процесса. Используя среднюю изохорную теплоемкость реального газа, можно приближенно рассчитать показатель политропы n. По заданной величине a определяют среднее значение теплоемкости политропного процесса на данном интервале температур как сm=сvm/a, и по этой теплоемкости рассчитывается показатель политропы:
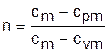 , (a)
, (a)
где срm=cvm+R.
При экспериментальном исследовании процессов изменения состояния газов получают опытные данные серии мгновенных значений термических параметров в виде графического или цифрового материала. Для проведения термодинамического анализа таких процессов необходимо установить, являются ли они политропными. В случае, если процесс соответствует политропному процессу, необходимо определить показатель политропы n. Если весь процесс не может рассматриваться как политропный, то он может быть разделен на участки, которые с достаточной степенью точности могут рассматриваться как политропные, и для каждого из этих участков определяется свое среднее значение показателя политропы n.
Рассмотрим некоторые из методов обработки и анализа опытных данных закономерных газовых процессов.
Оценить, относится газовый процесс к политропному или нет, наиболее просто, изобразив его в логарифмических координатах LnP–Lnv. Прологарифмировав уравнение политропы Pvn=const, получим уравнение
LnP + nLnv = A. (б)
В логарифмической системе координат LnP–Lnv это уравнение прямой линии. Следовательно, нанеся опытные точки процесса в данной системе координат, можно сделать вывод, относится ли данный процесс к политропному. Если все опытные точки ложатся на одну прямую (рис.4.9), то процесс подчиняется уравнению политропы Pvn=const. Если точки не ложатся на одну прямую, то это не политропный процесс. Однако в этом случае может быть проведена аппроксимация опытных точек с заменой действительного процесса политропным. Оценить пригодность такой политропы для расчетов процесса с заданной степенью точности можно по отклонению опытных точек от политропы.
 |
Для политропного процесса, изображенного в виде прямой в системе координат LnP–Lnv, показатель политропы легко определяется из уравнения (б) в виде углового коэффициента, который можно выразить через отношение отезков (см. рис.4.9):
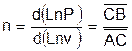 . (в)
. (в)
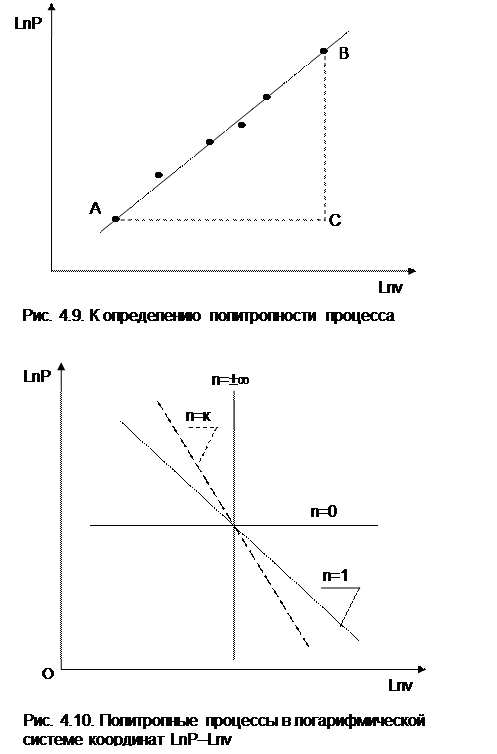
На рис.4.10 изображены политропные процессы в логарифмической системе координат с различными показателями политропы: n=0 – изобара, n=1 – изотерма, n=к – адиабата, n=±¥ – изохора.
Определить показатель политропы можно и по параметрам двух точек процесса. В случае если процесс соответствует политропе, для двух его точек можно записать равенство
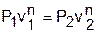 или
или 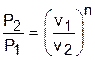 .
.
Прологарифмировав полученное равенство, получим расчетное выражение для показателя политропы:
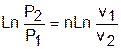 , ®
, ® 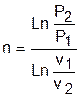 . (г)
. (г)
4.5. Качественный и количественный анализ политропных
процессов в Р,v- и T,s- диаграммах
При протекании любого газового процесса происходит энергообмен газа с внешней средой и изменение его параметров. Имея изображение политропного процесса в Р,v- и T,s- диаграммах, всегда можно определить знак теплоты, работы и знак изменения параметров этого процесса, т.е. провести качественный анализ процесса. Для иллюстрации этого на рис. 4.11 и 4.12 через произвольную точку А, определяющую начало процесса в Р,v- и T,s- диаграммах, проведены основные термодинамические процессы: изобара, изохора, изотерма, адиабата.
Во всех процессах, начинающихся в точке А и располагающихся справа от изохоры (n = ±¥), объем увеличивается (dv>0), и, следовательно, работа имеет положительный знак (dl=Pdv>0). В процессах, заканчивающихся слева от изохоры, знаки dv и dl отрицательные.
В процессах, располагающихся справа от адиабаты (n=к), энтропия возрастает (ds>0), и теплота имеет положительный знак (dq=Tds>0), т.е. теплота к газу подводится. В процессах, заканчивающихся с левой стороны от адиабаты, знаки ds и dq отрицательные.
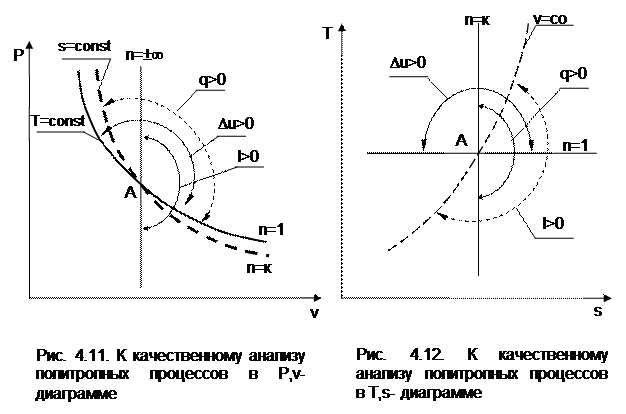
В процессах, заканчивающихся выше изотермы (n=1), температура возрастает (dT>0), и увеличивается внутренняя энергия и энтальпия газа (du=cvdT>0, dh=cpdT>0). В процессах с противоположной стороны от изотермы величины dT, du и dh отрицательные.
Поскольку площадь под процессом в P,v- диаграмме есть работа изменения объема, а в T,s- диаграмме – теплота, то, имея изображение процесса в этих координатах, можно дать и количественную характеристику процесса.
Например, на рис.4.13 изображен политропный процесс идеального газа 12 в Р,v- диаграмме. Площадь под процессом 122'1'1 есть работа изменения объема l. Изменению внутренней энергии процесса 12 соответствует работа любого адиабатного процесса в пределах температур от T1 до T2, т.е.
Du=u2-u1=ls=сv(T2- T1)=пл.2аа'2'2. (а)
Проведя адиабату через точку 2 и найдя точку пересечения с ней изотермы T1=const, получим процесс 2а, площадь под которым есть изменение внутренней энергии u2-u1. Сумма двух заштрихованных площадей представляет теплоту процесса
q = u2 - u1 + l = пл.12аа'1'1. (б)
Выражение первого закона термодинамики с использованием энтальпии,
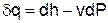 ®
® 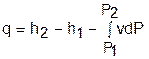 , (в)
, (в)
позволяет графически представить его составляющие в Р,v- координатах.
Величине – 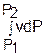 в Р,v- диаграмме соответствует площадь под процессом 12 в проекции на ось давлений 122"1"1.
в Р,v- диаграмме соответствует площадь под процессом 12 в проекции на ось давлений 122"1"1.
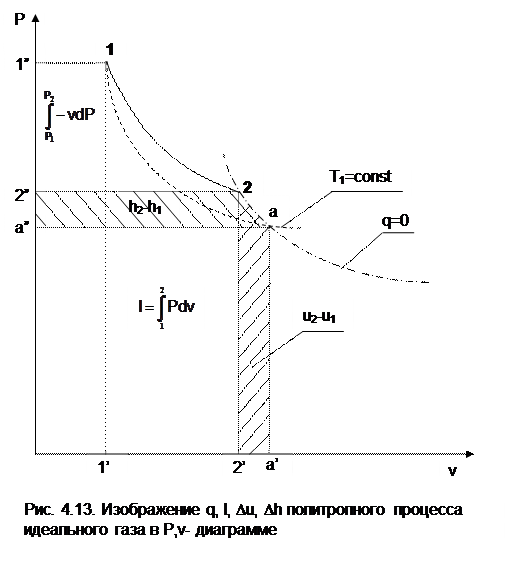 |
Разницу энтальпий можно представить в виде площади под адиабатным процессом 2а (dq = 0) в проекции на ось Р в интервале температур T1 и T2:
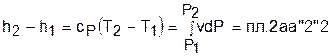 . (г)
. (г)
Сумма этих площадей есть теплота процесса q = пл.12aa"1"1.
В T,s- диаграмме площадь под процессом 1-2 (рис. 4.14) представляет теплоту этого процесса q=пл.122'1'1. Эту площадь, согласно первому закону термодинамики, можно представить в виде двух частей:
изменения внутренней энергии – площадь под любой изохорой в интервале температур Т1 и Т2:
u2 - u1 = qv = cv(Т2 - Т1) = пл.22'а'а2; (д)
и работы изменения объема, представляющей разность теплоты и изменения внутренней энергии процесса 12:
l = q - (u2 - u1) = пл.12аа'1'1. (е)
Изменение энтальпии в процессе 12 можно представить в виде площади под любой изобарой в интервале температур Т1 и Т2:
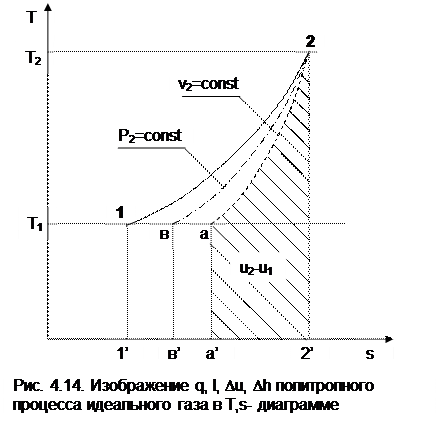 |
h2 - h1 = qp = сp(Т2 - Т1) = пл.2вв'2'2. (ж)
Таким образом, имея изображение политропного процесса газа в Р,v- или T,s- диаграмме, можно оценить величину и знак теплоты, работы изменения объема, изменения внутренней энергии, энтальпии и других термодинамических параметров состояния.
Date: 2015-05-09; view: 1271; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |