
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термические свойства реальных газов
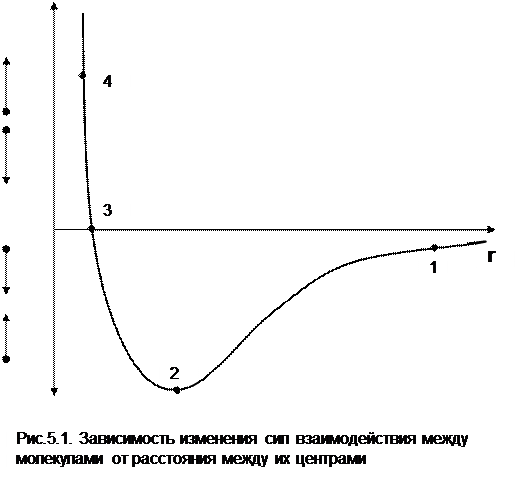
Реальные газы отличаются от своей модели – идеальных газов – тем, что их молекулы имеют конечные размеры и между ними действуют силы притяжения (при значительных расстояниях между молекулами) и отталкивания (при сближении молекул друг с другом). Характер изменения этих сил взаимодействия в зависимости от расстояния между центрами молекул r показан на рис. 5.1. На рис. 5.2 в Р,v- диаграмме представлена изотерма реального вещества 1234 и изотерма идеального газа ав. Характер поведения изотермы реального вещества 1234 (рис.5.2) можно частично объяснить характером изменения сил взаимодействия между молекулами (см. рис.5.1) в зависимости от расстояния между их центрами при изменении давления, считая, что на обоих рисунках линии 1234 соответствует одна и та же изотерма.
В точке 1 при малых давлениях расстояние между молекулами большое (очень), здесь действуют небольшие силы взаимного притяжения молекул. На участке 12 при увеличении давления газ сжимается, объем его уменьшается. По мере увеличения давления и уменьшения объема молекулы сближаются, силы притяжения возрастают и достигают максимума в точке 2. Силы взаимного притяжения молекул обусловливают появление внутреннего давления, которое возрастает по мере сближения молекул и приводит к более интенсивному изменению объема газа. Действие сил притяжения молекул в точке 2 аналогично действию пружины, которая полностью растянута.
Далее, начиная с точки 2 и до точки 3 (рис.5.2), газ будет переходить в жидкую фазу, т.е. здесь одновременно существуют газовая и жидкая фазы при одинаковых давлениях и температурах. В отношении двух молекул это динамичный процесс сближения, и двух фаз здесь быть не может (рис.5.1), в точке 2 был газ, а в точке 3 стала жидкость. При этом силы взаимного притяжения молекул уменьшаются, и в точке 3, где весь газ вступил в жидкую фазу, силы притяжения уравновешиваются силами отталкивания (условная пружина находится в свободном состоянии, не сжата и не растянута).
  |
Уменьшение объема в процессе 23 (рис. 5.2), с одной стороны, обусловлено внутренним давлением, которое падает в среднем до нуля в точке 3, а с другой стороны, объясняется образованием жидкой фазы, т.е. по мере увеличения капелек жидкости в смеси уменьшается количество газа, для газа объем соответствует точке 2, а для жидкости – точке 3, в результате удельный объем смеси при фазовом переходе уменьшается от точки 2 до точки 3.
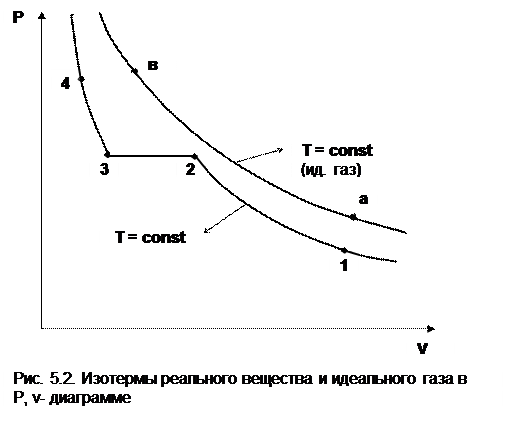 |
При дальнейшем увеличении давления (процесс 34 на рис.5.1 и 5.2) сжимается только жидкая фаза, при этом расстояния между молекулами настолько малы, что преобладают силы отталкивания, т.к. на сжатие уже оказывает влияние собственный объем молекул, соизмеримый со свободным объемом жидкой фазы. То есть собственный объем молекул оказывает противоположное воздействие силам взаимного притяжения (условная пружина полностью сжата). В результате этого воздействия дальнейшее увеличение давления не приводит к значительному уменьшению объема жидкой фазы, т.е. жидкость – плохо сжимаемая фаза вещества.
Переход веществ из газообразного состояния непосредственно в жидкое при атмосферных условиях возможен не для всех веществ. Например, двуокись углерода СО2 поддавалась этому переводу, а воздух, кислород, азот – нет. Поэтому долгое время жидкая и газообразная фазы вещества рассматривались как принципиально различные с различными свойствами, как твердая и жидкая фазы. Причина такой разницы в поведении газов была не ясна. Позднее было установлено, что такой фазовый переход можно обнаружить для всех газов, но для некоторых из них он достигается при очень низких температурах.
Эта точка зрения коренным образом изменилась после опытов, проведенных английским физиком Т. Эндрюсом в 1857–1869 гг. [10].
Эндрюс экспериментально исследовал Р,v,T - зависимости для двуокиси углерода (углекислоты) СО2, подвергая ее сжатию при различных постоянных температурах. Полученные в результате экспериментов зависимости представлены на рис. 5.3.
 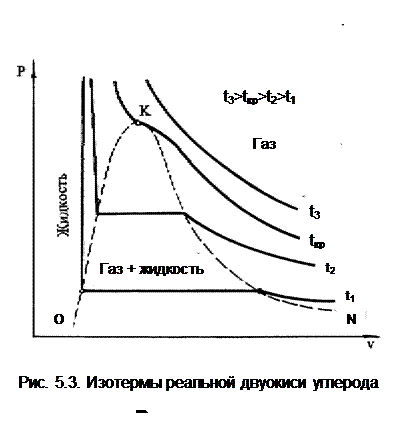 |
При сравнительно низкой температуре с повышением давления сначала объем плавно уменьшается. При достижении определенного для каждой температуры давления объем уменьшается без изменения давления, при этом в прозрачной трубке, где находится СО2, можно визуально наблюдать переход газа в жидкость при наличии поверхности раздела фаз. После превращения всей газовой фазы в капельную жидкость дальнейшее повышение давления незначительно сказывается на изменении объема, и изотерма резко поднимается вверх.
При повышении температур давление фазового перехода повышается, а разность удельных объемов в начале и в конце этого перехода, т.е. горизонтальный участок изотермы в Р,v - диаграмме, уменьшается. При определенной температуре, называемой критической, этот горизонтальный участок исчезает совсем, а при более высоких температурах (t3) изотермы протекают монотонно без видимого фазового перехода.
Опытами Эндрюса и последующими исследованиями других ученых была установлена непрерывность газообразного и жидкого состояния вещества, было доказано, что нет резкой границы между физическими свойствами этих фаз. Можно, обойдя критическую точку сверху, перейти из области жидкости в область газовой фазы или наоборот без видимого фазового перехода.
Газ и жидкость являются изотропными фазами вещества с одинаковым характером молекулярных взаимодействий и беспорядочным движением микрочастиц.
В отличие от газа и жидкости твердое кристаллическое вещество является анизотропным. Переход кристаллического вещества в жидкость без видимого фазового перехода не удается получить при любых доступных для воспроизведения давлениях. Для некоторых веществ, изоэнтропных, некристаллических в твердом состоянии: стекла, парафина, гудрона и т.п., – допустим переход из твердой фазы в жидкую и наоборот, без видимого скачка свойств. Эти вещества иногда называются твердыми жидкостями. Для них возможно сразу перейти из жидкой фазы в твердую, и наоборот.
Важнейшими термодинамическими характеристиками вещества являются параметры его критического состояния: Ркр, Tкр, vкр. Они неодинаковы для различных веществ и выражают в обобщенной количественной форме эффект действия молекулярных сил. На критической изотерме, проходящей через точку К, горизонтальный участок имеет нулевую длину, т.е. здесь нет разницы плотностей жидкой и газовой фаз. Превращение жидкости в пар при Р<Ркр требует затраты теплоты парообразования. В критической точке при Ркр теплота парообразования нулевая, ее нет.
Критическая точка для критической изотермы в Р,v- координатах является точкой перегиба, в этой точке касательная к изотерме представляет собой горизонталь, и, следовательно, для критической точки
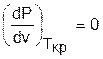 и
и 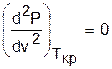 .
.
Сверхкритические изотермы (Т>Ткр) в Р,v- диаграмме не имеют горизонтальной касательной, для них всегда (dР/dv)T<0. Для изотерм, близких к критической, характерно наличие перегиба, постепенно исчезающего с повышением температуры.
Для некоторых веществ критические параметры приведены в табл. 5.1.
Таблица 5.1 Критические параметры некоторых веществ
| Вещество | tкр, оС | Ркр, МПа | Вещество | tкр, оС | Ркр, МПа |
| Гелий Водород Азот Кислород | -268 -240 -147 -118,4 | 0,225 1,25 3,28 4,87 | Углекислота Вода Натрий Углерод Ртуть | 374,12 | 7,38 22,12 35,0 700,0 |
Из табл. 5.1 видно, почему СО2 выбрана Эндрюсом для опытов. Критические параметры СО2 невелики, поэтому их было просто технически получить в то время.
Проведенные Эндрюсом опыты показали непрерывность свойств газообразной и жидкой фаз реальных веществ и их отличие от идеальных газов. Для анализа этих различий наравне с Р,v- диаграммой широко используется Рv,Р- диаграмма. В этой диаграмме изотермы идеальных газов в соответствии с уравнениями Рv=const и Рv=RT представляют собой горизонтальные прямые.
Рассмотрим различие в свойствах реальных веществ и идеальных газов на примере анализа их изотерм в Р,v- и Рv,Р- диаграммах (рис.5.4, 5.5). Свойства веществ в этих диаграммах наглядно иллюстрируются изменением их сжимаемости для изотермических процессов. Сжимаемость при T=const – это -(dv/dР)Т, т.е. изменение удельного объема при изменении давления, взятая с обратным знаком. Эта величина, отличающая свойства идеальных газов от реальных веществ, также характеризует действие сил межмолекулярного взаимодействия. Так как в Р,v- диаграмме сжимаемость представляет собой тангенс угла наклона между касательной к изотерме и обратным направлением оси давлений Р, то для изотермы идеальных газов в точке а она будет равна tgb, а для изотермы реальных веществ, проходящей через ту же точку, сжимаемость будет равна tga. С увеличением давления сжимаемость обоих веществ будет уменьшаться. Однако для идеального газа она уменьшается в соответствии с закономерностью уравнения изотермы Рv=const. Сжимаемость реального вещества с ростом Р тоже уменьшается, но на разных участках изотермы (ам и мв) отличается от сжимаемости идеального газа, причем отличие может быть как в сторону увеличения, так и в сторону уменьшения. В точке а tga> tgb, т.е. сжимаемость реального вещества больше, чем идеального газа. В точке в, наоборот, сжимаемость идеального газа больше, чем реального вещества. В точке М, где изотерма идеального газа касательна к изотерме реального вещества, их сжимаемости одинаковы.
Оценить изменение сжимаемости реального вещества по отношению к сжимаемости идеального газа, а следовательно, и отличие свойств реальных веществ от свойств идеальных газов позволяет изображение их изотерм в Рv,Р- диаграмме рис. 5.5. В этой диаграмме изотермы идеального газа – прямые горизонтальные линии. Рассмотрев соответствующие изотермы из Р,v- диаграммы ав, аМв и идеальную изотерму, проходящую через точку М, видим, что в случае (d(Рv)/dР)T<0 линия аМ – область низких давлений, сжимаемость реальных газов больше, чем у идеальных; при (d(Рv)/dР)T>0 линия Мв – область больших давлений, здесь сжимаемость реальных газов меньше, чем у идеальных. В точке М линия Рv касательна к изотерме реальных газов, т.е. при (d(Рv)/dР)T=0 их сжимаемости одинаковы.
Величина изменения сжимаемости реального вещества по отношению к идеальному газу, обусловленная наличием сил межмолекулярного взаимодействия, характеризуется величиной (d(Рv)/dР)T. Это очень удобное выражение, т.к. оно оценивает подчиненность свойств реальных веществ уравнению состояния идеальных газов. (В разделе "Дросселирование газов и паров" [2] оценка изменения сжимаемости также ведется по (d(Рv)/dР)h). Так при (d(Рv)/dР)T=0 реальный газ не только имеет одинаковую с идеальным сжимаемость, но и может быть описан уравнением Менделеева – Клапейрона. На рис. 5.5 изотермы реального газа, имеющие минимум, соответствующий равенству (d(Рv)/dР)T=0, дают кривую КМВ, называемую кривой Бойля. Здесь К – критическая точка, а В называется точкой Бойля, ТВ – температура Бойля, эта изотерма совпадает своим минимумом с осью давлений. Для многих веществ выполняется равенство
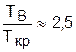 .
.
Участок изотермы ТВ=const в области низких давлений близок к горизонтали. При Т=ТВ реальный газ подчиняется законам идеальных газов, то же наблюдается и вблизи точки Бойля.
Изотермы, соответствующие температурам выше ТВ, не имеют минимума в системе координат Рv,Р, для них всегда (d(Рv)/dР)T>0, т.е. реальный газ имеет меньшую сжимаемость, чем идеальный.
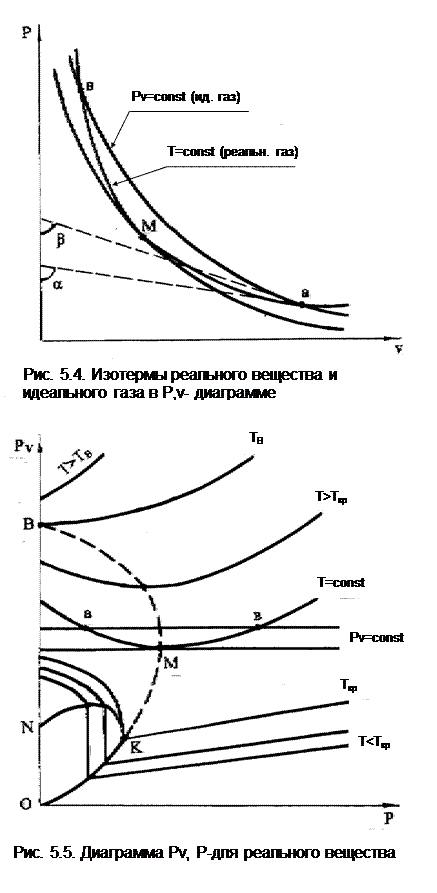
Кривая Бойля КМВ совместно с кривой кипящей жидкости КО делят всю площадь диаграммы Рv,Р на две области:
слева от них (d(Рv)/dР)T<0, т.е. сжимаемость реального вещества больше, чем идеального газа,
справа (d(Рv)/dР)T>0, т.е. сжимаемость реального газа меньше, чем идеального.
В области двухфазного состояния OKNО (d(Рv)/dР)T=-µ, т.е. Рv представляют вертикальные прямые, идущие вверх от линии кипящей жидкости КО до линии КN, где вся жидкая фаза перешла в пар. В этой области, как и в Р,v- диаграмме, изотермы совпадают с изобарами. На изотерме-изобаре в двухфазном состоянии сжимаемость газа и жидкой фазы не изменяется, изменяется только их количество в смеси. Линии ОК соответствует сжимаемость жидкости в состоянии кипения, а линии КN – газа (пара) при той же температуре.
5.2. Уравнения состояния реальных газов.
Date: 2015-05-09; view: 1203; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |