
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтальпия идеальных газов
Энтальпия h = u + Рv, как любой параметр состояния, может быть определена через любую пару независимых параметров состояния. Выразим полный дифференциал энтальпии, используя при его определении в качестве независимых термических параметров Р и Т:
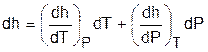 . (3.45)
. (3.45)
Для изобарного процесса при Р=const, используя первый закон термодинамики, получим выражение
dqp = cpdT = (dh - vdР)p = dhp, (3.46)
в соответствии с которым изобарная теплоемкость определяется как
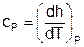 . (3.47)
. (3.47)
Применив уравнение (3.47) к (3.46), получим выражение для определения элементарного изменения энтальпии реальных веществ:
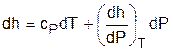 . (3.48)
. (3.48)
Для этальпии идеального газа, подчиняющегося уравнению Pv=RT, будет выполняться равенство
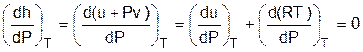 , (3.49)
, (3.49)
т.е. энтальпия идеальных газов не зависит от давления, а выражение (3.48) для идеальных газов примет вид
dh = cpdT. (3.50)
Поскольку изобарная теплоемкость идеальных газов величина постоянная, то энтальпия идеальных газов есть функция только температуры. В свою очередь, для изобарной теплоемкости идеального газа не зависимо от процесса справедливо выражение
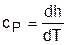 . (3.51)
. (3.51)
Абсолютное значение энтальпии можно получить интегрированием выражения (3.48). При этом необходимо выбрать начало ее отсчета, приняв ho при фиксированных параметрах газа Ро и То.

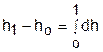 или
или 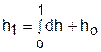 . (3.52)
. (3.52)
Необходимо помнить, что начало отсчета энтальпии и внутренней энергии связаны соотношением
ho = uo + Povo, (3.53)
в соответствии с которым, приняв uo=0, получим ho = Povo, т.е. начало отсчета энтальпии будет больше нуля.
При различных значениях Ро и То будут различными и абсолютные значения энтальпии. Однако в расчетах процессов используется разница энтальпий, а не их абсолютные значения. Для разницы энтальпий процесса выбор параметров начала отсчета энтальпии никакой роли не играет:
 . (3.54)
. (3.54)
Прокомментируем расчет абсолютного значения энтальпии на примере идеального газа. Примем начало отсчета энтальпии идеального газа ho при 0 оС. Приняв при 0 оС uo=0, получим ho=uo+Povo=RTo=273,15R, тогда абсолютное значение энтальпии вычисляется по формуле
h-ho=cp(t-0) или h=cpt+ho=cpt+273,15R. (3.55)
Приняв начало отсчета энтальпии и внутренней энергии идеального газа от абсолютного нуля То=0 К и задав uo=0, получим ho=Povo=RTo=0R=0, т.е. в данном случае численные значения начала отсчета внутренней энергии и энтальпии одинаковы и равны нулю. Расчетное выражение абсолютной энтальпии в этом случае будет представлено в виде
h - ho = h - 0 = cp(T-0) или h = cpT. (3.56)
Абсолютные значения энтальпий по выражениям (3.55) и (3.56) при одинаковых температурах будут разные, но разница энтальпий в одинаковом интервале температур будет одинаковой:
h2 - h1 = cp(t2-t1) = cp(T2-T1). (3.57)
Таким образом, в расчетах абсолютного значения энтальпии основным требованием является необходимость выбора одинаковых параметров для принятия начала отсчета внутренней энергии и энтальпии. Для идеального газа начало отсчета энтальпии и внутренней энергии фиксируется только температурой.
При расчете разности энтальпий выбор параметров начала отсчета энтальпии никакой роли не играет. Поэтому, если сразу рассчитывается разность энтальпий (выражение (3.55), то параметры начала отсчета энтальпии вообще не нужны, если разница энтальпий определяется через их абсолютные значения h2 - h1, то они должны иметь одинаковые (любые) параметры начала их отсчета.
Date: 2015-05-09; view: 1381; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |