
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальные газы. Уравнение Ван-Дер-Ваальса
Как отмечалось ранее, кинетическая теория идеального газа не учитывает сил взаимодействия молекул, сами же молекулы принимаются за точки. Такая модель соответствует достаточно разреженному газу, подчиняющемуся законам Бойля -Мариотта и Гей-Люссака.
Многочисленные опыты показали, что все газовые законы и, в частности, формула Клайперона - Менделеева носят приближенный характер. Чем сильнее сжат газ, тем заметнее его отклонение от газовых законов. Для того, чтобы можно было применить формулу Клайперона - Менделеева к реальным газам, очевидно, необходимо ввести в нее какие-то поправки. Одно из наиболее удачных уточнений этой формулы предложил в 1983 г. голландский физик Ван-дер-Ваальс.
Первое уточнение Ван-Дер-Ваальса касается объема самих молекул. В 1см3
газа при нормальных условиях содержится 2,7 1019 молекул. Принимая эффективный диаметр молекулы равным 3·10-8см, определяем, что ее объем равен 1,2·10-23см3. Находим, что объем всех молекул, находяхщихся в 1см3 газа при нормальных условиях, составляет около 3·10-4см3. Однако при давлении 2500 атм объем самих молекул уже составит половину всего объема газа. Поэтому при высоких давлениях объем газа, занимаемый самими молекулами, необходимо учитывать.
Так как при сжатии газа уменьшается обратно пропорционально давлению не весь объем, а объем свободного пространства между молекулами, в формуле Клайперона - Менделеева вместо V следует ввести (V-b), где b – объем несжимаемой части газа. По вычислению Ван-Дер-Ваальса, b приблизительно равно учетверенному объему всех молекул. Поясним, как получается такой результат.
Действительно, центры молекул не смогут сблизиться больше, чем на расстояние, равное удвоенному эффективному радиусу (2r), т.е. проникнуть в пространство, соответствующее объему шара радиуса 2r (см. рис. 3.1). Объем такого шара равен 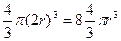 , т.е. восьмикратному объему одной молекулы (V 0=
, т.е. восьмикратному объему одной молекулы (V 0= 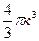 ) Следовательно, каждой из двух выделенных молекул соответствует объем несжимаемого пространства, равный учетверенному объему одной молекулы (4V0).
) Следовательно, каждой из двух выделенных молекул соответствует объем несжимаемого пространства, равный учетверенному объему одной молекулы (4V0).
Второе уточнение, введенное Ван-Дер-Ваальсом, касается давления газа. При разреженном состоянии газа силы сцепления между его молекулами ничтожно малы. Однако при сжатии газа промежутки между молекулами уменьшаются и силы их взаимодействия возрастают. Эти силы притяжения молекул друг к другу как бы помогают силам внешнего давления сжимать газ. Следовательно, в формулу Клайперона - Менделеева вместо внешнего давления p на газ необходимо ввести сумму внешнего и молекулярного давлений (p+p'), где p' – молекулярное давление. По вычислениям Ван-Дер-Ваальса, молекулярное давление обратно пропорционально квадрату объема газа, т.е.

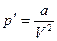 ,
,
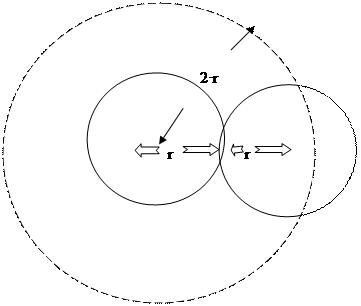 |
Рис. 3.1. Объем пространства, недоступный центрам двух молекул в процессе их соударения (штрихованная линия)
где a – некоторый коэффициент пропорциональности, зависящий от природы газа.
Вводя указанные поправки, получим формулу
 , (3.1)
, (3.1)
называемую уравнением Ван-Дер-Ваальса и записанную для массы газа, равной одному молю (Vμ - объем одного моля газа). Значения коэффициентов a и b приводятся в справочниках также для 1 моля газа. Если масса m газа содержит ν=m/μ молей, то объем газа при прочих равных условиях увеличится в ν раз, т.е. V=νVμ или Vμ=V/ν. Заменив молярный объем Vμ в формуле (3.1) при помощи полученного соотношения, получим уравнение Ван-дер-Ваальса для любой массы газа:
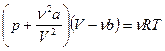 . (3.2)
. (3.2)
Как мы уже отмечали, формула Клайперона - Менделеева хорошо описывает поведение достаточно разреженных газов. В табл. 3.1 приведены опытные данные для массы азота, занимающей при нормальных условиях объем, равный одному литру. Во втором столбце таблицы приведены значения произведения p V при разных давлениях и одной и той же температуре 0˚C. Это произведение согласно уравнению Клайперона - Менделеева должно оставаться постоянным, а отличие его от единицы указывает на отклонение поведения реального газа от идеального. Как видим, сколько-нибудь заметные расхождения с уравнением состояния идеального газа возникают при давлениях в сотни атмосфер и с ростом давления становятся существенными. В третьем разделе таблицы приведено при тех же условиях произведение подправленных давления и объема, которое должно оставаться постоянным при фиксированной температуре в соответствии с уравнением Ван-Дер-Ваальса. Как видим из таблицы, уравнение Ван-Дер-Ваальса гораздо лучше согласуется с экспериментом, чем уравнение Клайперона – Менделеева.
Т а б л и ц а 3.1
| Р, атм | pV, aтм · л | 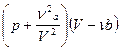 , атм · л , атм · л
|
| 1,000 0,994 1,048 1,390 2,069 | 1,000 1,000 1,009 1,014 0,893 |
Date: 2015-05-09; view: 728; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |