
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения задач. Какую температуру T имеет масса m=2г азота, занимающего объем V=820см3 при давлении p=0,2МПа?
Задача 1
Какую температуру T имеет масса m=2г азота, занимающего объем V=820см3 при давлении p=0,2МПа? Газ рассматривать как а) идеальный; б)реальный.
| Дано: N2 m=2·10-3кг V=8,2·10-4м3 Р=2·105Па | Решение: Μ=2,8·10-2кг/моль а) pV=m/μ·RTa Ta=μpV/mR=280K б) Запишем уравнение Ван-Дер-Ваальса: |
| Та=? Тб=? |
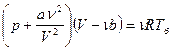 ,
, 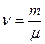 .
.
Значения параметров а и в определим по критическим параметрам для азота согласно формулам (3.9):
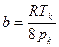 ,
, 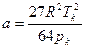 .
.
Значения рк, Тк возьмем из таблицы 3.2: рк=3,4·106Па, Тк=126К
Такие действия приведут нас к следующим выводам:
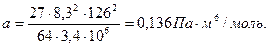
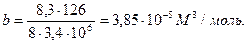 μ=2/28=0,71 моль=
μ=2/28=0,71 моль=
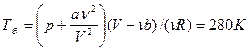 .
.
Совпадение Та и Тб в данном случае объясняется малой величиной давления, при котором реальный газ ведет себя как идеальный.
Задача 2
Найти эффективный диаметр d молекулы кислорода, считая известными для кислорода критические значения Tк и pк.
| Дано: О2 | Решение: Постоянная b, входящая в уравнение Ван-Дер-Ваальса, равна учетверенному объему Na молекул (одного моля газа). |
| d=? |
Это означает:
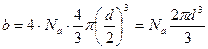 .
.
С другой стороны, согласно формуле (3.9) b= 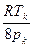 . Приравнивая правые части этих двух соотношений и учитывая, что R/Na=k, получим:
. Приравнивая правые части этих двух соотношений и учитывая, что R/Na=k, получим:
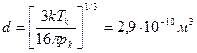 .
.
Задача 3
Давление водяного пара, насыщающего пространство при t=50˚C равно p=12302Па. Определить массу воды, содержащуюся в 1м3 воздуха.
| Дано: Н2О Т=323К р=12302Па V=1м3 | Решение: При таких температурах пар можно описывать уравнением Клайперона-Менделеева (см. стр. 59), поэтому: pV=mRT/μ и m= μpV/(RT)/ Поскольку μ=1,8·10-2кг/моль, получим: |
| m=? |
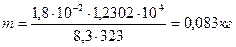 .
.
Задача 4
Какая масса m водяного пара содержится в объеме V=1м3 воздуха в летний день при температуре t=30˚C и относительной влажности w=75%?
| Дано: Н2О Е=303К w=0,75, V=1м3 | Решение: Поскольку w=р/рн, то р=рн·w, ф давление насыщающего пара при данной температуре рн=4,23·103Па. Эту же величину можно выразить из уравнения состояния: |
| m=? |
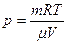 .
.
Из этих соотношений найдем:
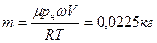 .
.
Задача 5
Какая часть удельной теплоты парообразования воды r=2,29МДж/кг при температуре t=100˚C идет на увеличение внутренней энергии системы?
| Дано: Н2О Т=373К R=2,29·106 Дж/кг | Решение: В процессе испарения теплота тратится на преодоление сил взаимодействия молекул и на работу расширения против сил внешнего давления. |
| ΔU/r=? |
Согласно первому началу термодинамики (поскольку Q=r) имеем:
r=ΔU+A,
где A - работа, совершаемая единицей массы m1=1кг газа против внешнего давления. Эта работа равна A=p(Vпара-Vж). А, поскольку температура далека от критической, плотность пара рпара=m1/Vпара значительно меньше плотности жидкости рж=m1/Vж, из которой он образован:
рпара<<pж, или Vж<<Vпара.
Поэтому в выражении для работы можно пренебречь величиной Vж по сравнению с Vпара и получить: A≈pVпара. Далее, воспользовавшись уравнением Клайперона - Менделеева для пара:
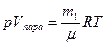 ,
,
замечаем, что A≈m1RT/μ. А, поскольку из выражения для первого начала термодинамики можно получить (вычитая A и поделив обе части равенства на r):
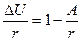 ,
,
к окончательному результату можно прийти, заменяя работу ее приближенным выражением:
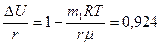
Таким образом, при испарении воды преобладают затраты энергии на увеличение внутренней энергии, а доля работы против сил внешнего давления мала.
Date: 2015-05-09; view: 1771; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |