
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тепловой эффект процесса в изобарных условиях
Пусть наряду с теплообменом на границах системы с внешней средой совершается работа А.Будем считать, что некий технологический процесс или химическая реакция осуществляется в условиях постоянства давления внутри системы (P = const), то есть в изобарических условиях. Это означает, что система совершает работу по преодолению сил внешнего давления (работа расширения), которая положительна А = РDV
Тогда
qр = (U2 -U1) + Р(V2 - V1)
или
qр = (U2 + PV2) - (U1 + PV2).
Введем новую функцию состояния системы H = U + PV.
Отсюда,
qр = ΔН (или в дифференциальной форме 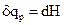 )
)
Н – энтальпия (в переводе с греч. «нагреваться»), непрерывная, однозначная и конечная функция состояния системы, приращение которой ΔН равно теплоте, поглощенной системой в изобарических условиях. Абсолютные значения энтальпии не известны. Единицы измерения – Дж, Дж/моль.
Величины ΔН и 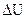 связаны друг с другом соотношением Клаузиуса:
связаны друг с другом соотношением Клаузиуса:
DH = DU + DnRT, где Dn – разность между числом молей газообразных веществ в конечном и начальном состояниях 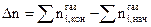 . (например, СО2+С=2СО; Dn=2-1=1
. (например, СО2+С=2СО; Dn=2-1=1
Для эндотермических процессов DH>0 (DU>0).
Для экзотермических процессов DH<0 (DU<0)
1.5. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
Первый закон термодинамики является основой для анализа физико-химических превращений, которые связаны с переходом тепла или изменением внутренней энергии системы. Его используют: для определения характеристик процессов, происходящих в идеальных газах; для определения тепловых эффектов термодинамических процессов.
Анализ процессов, протекающих в идеальных газах, основан на использовании первого закона термодинамики, который позволяет определить изменение внутренней энергии, теплоту и работу таких процессов. Для расчета используются уравнения, приведенными в таблице.
| Процессы | q | DU | A |
| изотермический | nRTlnV2/V1 | nRTlnV2/V1 | |
| изобарный | n Ср×DТ | q-A | A=PDV=nRDT |
| изохорический | nСv×DТ | nСv×DT |
Применение первого закона термодинамики в термохимии.
Термохимия - это раздел физической химии, изучающий тепловые эффекты химических реакций и физико-химических процессов (например, плавление, гидратация и т.д.). Задача, которая стоит перед термохимией – без проведения измерений оценить, рассчитать тепловые эффекты химических реакций и превращений.
Тепловой эффект – это количество теплоты, которое выделяется или поглощается в процессе реакции, протекающей при постоянном давлении или при постоянном объеме, когда температура начального и конечного состояния системы одинакова.
Закон Гесса в 1836 году русский ученый Герман Иванович Гесс в результате анализа калориметрических исследований сформулировал основной закон термохимии, который получил его имя.
Тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Или иначе, ²Тепловой эффект химической реакции при постоянном объеме или постоянном давлении не зависит от пути хода реакции, т.е. от промежуточных стадий, а зависит только от начального и конечного состояния системы²
Например, рис.2. иллюстрирует закон Гесса.
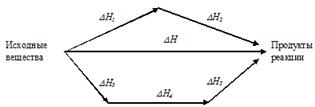
На этом рисунке химические реакции обозначены стрелками. Приведены тепловые эффекты этих реакций. Предполагается, что от исходных веществ к продуктам можно перейти либо в результате одной реакции с тепловым эффектом DН, либо двух последовательных реакций с тепловым эффектами DН1 и DН2, либо трех последовательных реакций с тепловыми эффектами DН3, DН4 и DН5.
В соответствии с законом Гесса:
DН = DН1 + DН2 = DН3 + DН4 + DН5
Закон Гесса справедлив в следующих условиях:
- объем или давление постоянны,
- не совершается никакой работы, кроме работы расширения идеального газа,
- температура исходных веществ и продуктов одинакова.
Закон Гесса позволяет:
1) рассчитать тепловые эффекты множества реакций по справочным данным;
2) рассчитывать тепловые эффекты реакций, не осуществимых на практике, например, теплоты образования кристаллогидрата или тепловой эффект фазового перехода.
Например, газ СО2 может быть получен двумя способами: прямым окислением или доокислением газа СО по схеме:
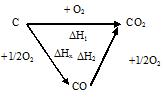
По закону Гесса 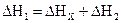 . Тепловые эффекты
. Тепловые эффекты 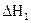 и
и 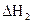 можно измерить, тогда теплота реакции С + 1/2O2 = CO +DНх, может быть определена как разность теплот DН1 и DН2:
можно измерить, тогда теплота реакции С + 1/2O2 = CO +DНх, может быть определена как разность теплот DН1 и DН2:
DНх = DН1 - DН2.
Для вычисления теплот химических реакций используют 4-ре следствия из закона Гесса.
Первое следствие из закона Гесса
Это следствие связано с теплотами образования вещества. Теплотой (энтальпией) образования вещества называется количество теплоты, которое выделяется, или поглощается при образовании 1 моля сложного вещества из простых веществ, находящихся в наиболее устойчивом состоянии.
Следствие 1. Тепловой эффект химической реакции равен разности сумм теплот образования конечных и начальных веществ с учетом стехиометрических коэффициентов.
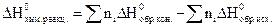
Теплоты образования веществ измеряются и приводятся для стандартных условий в справочниках. Теплоты образования элементов приняты равными НУЛЮ. Условия протекания хим. реакции называются стандартными, если температура равна 298 К, а реагирующие вещества взяты в стандартном состоянии, за которое для жидкого или твердого вещества принимается наиболее устойчивая форма при стандартной температуре и нормальном атмосферном давлении (1 атм). Для газа принимается состояние, при котором газ находится под давлением 1 атм (101324 Па).
Второе следствие из закона Гесса
В некоторых случаях удобнее вычислять тепловой эффект реакции по теплотам (энтальпиям) сгорания веществ, участвующих в реакции. Теплотой (энтальпией) сгорания – это тепловой эффект реакции окисления 1 моль вещества до высшего оксида.
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных и конечных веществ, участвующих в реакции, с учетом стехиометрических коэффициентов.
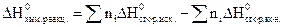
Теплоты сгорания веществ также приведены в справочных таблицах. Теплоты сгорания высших оксидов равны нулю.
Следствие 3. Тепловой эффект обратной реакции равен по величине и обратен по знаку тепловому эффекту прямой реакции
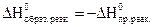
Следствие 4. Термодинамическими уравнениями можно оперировать как алгебраическими, т.е. их складывать и вычитать.
Например, необходимо рассчитать теплоту перехода графита в алмаз по реакции:
Сграфит +О2 = СО2 - 394,078 кДж (1)
Салмаз + О2 = СО2 - 395,976 кДж. (2)
Из уравнения (1) почленно вычитаем уравнение (2) и получаем:
Cграфит----------® Салмаз + 1,898 кДж.
1.6. Теплоемкость
Теплоемкостью системы называется отношение количества сообщенной ей теплоты к вызываемому этим повышению температуры.
Теплоемкость системы, соответствующая бесконечно малому изменению температуры, называется истинной теплоемкостью:
С = 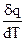 (1.1)
(1.1)
Теплоемкость экстенсивная характеристика системы и может быть отнесена к единице массы, молю или единице объема вещества, что соответствует удельной, мольной (молярной) и объемной теплоемкостям. Их размерности, соответственно, Суд, Дж/(г×К) или Дж/(кг×К). Смоль, Дж/моль×К. Соб, кДж/(м3×К)
В зависимости от условий, в которых производится нагрев, различают изобарную теплоемкость - СР (при P = const) и изохорную теплоемкость - СV (при V = const).
В этом случае:
 и
и 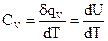 теплоемкость приобретает свойства функций состояния. Таким образом, из приведенных зависимостей следует, что с ростом температуры энтальпия и внутренняя энергия увеличиваются.
теплоемкость приобретает свойства функций состояния. Таким образом, из приведенных зависимостей следует, что с ростом температуры энтальпия и внутренняя энергия увеличиваются.
На практике работают со средней теплоемкостью, которая определяется соотношением:
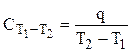 ,
,
где q - количество теплоты, за счет получения (отдачи) которой, температура системы повышается (понижается) от температуры Т1 до Т2.
Средняя и истинная теплоемкости связаны уравнением
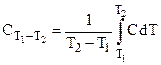 .
.
Зависимость теплоемкости от температуры приведена на рис.3.:
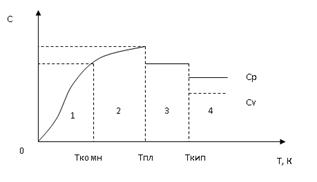
На 1 участке зависимость теплоемкости веществ от температуры описывается уравнением Дебая
С = aТ3, иногда С = АТ3
где a (А) - коэффициент, зависящий от природы вещества, его можно рассчитать.
Из уравнения Дебая следует, что если Т®0, то С®0.
В 1819 году французские ученые Пьер Дюлонг и Алекси Пти экспериментально доказали, что мольная теплоемкость одноатомных веществ при комнатной температуре примерно одинакова и равна 26,3 Дж/моль*К – Правило Дюлонга и Пти
В 1831 году немецкие физики Франц Нейман и Герман Копп доказали, что теплоемкости сложных веществ являются аддитивной величиной и определяются как сумма отдельных элементов. Например,
| Элемент | Металл | Углерод | Сера | Водород | Фтор | Кислород |
| С, Дж/(моль*К) | 7,6 | 22,6 | 9,6 | 21,0 | 16,8 |
Т.о., СMgCO3 = 26+7,6+3*16,8 = 84 Дж/(моль*К).
Правило Неймана-Коппа:
Теплоемкость многоатомных твердых тел при комнатной температуре равна произведению числа атомов в молекуле вещества на 26,3 Дж/моль×К (СР=n×26,3).
Участок 2 от комнатной температуры (Тком) до температуры плавления вещества; температурная зависимость теплоемкости вещества может быть описана уравнением степенного ряда вида
С = a + bТ + gТn, где n= ±2 или ± 1/2. Число варьируемых параметров зависит от точности имеющихся данных и ширины исследованного температурного интервала.
Коэффициенты a, b, g индивидуальны для различных химических веществ, определяются опытным путем и приводятся в справочниках термодинамических величин.
Например, СР(Мg)=22,3+10,6×10-3×Т-0,42×105×Т-2, Дж/моль×К.
При плавлении теплоемкость веществ уменьшается скачком и в интервале температур от Т плавления - Т кипения теплоемкость жидкости практически не зависит от температуры, чаще всего C=const (участок 3).
Участок 4 характеризует теплоемкости газов и веществ в парообразном состоянии. При переходе вещества в парообразное состояние теплоемкость веществ уменьшается. Для паров и газов различают теплоемкость при постоянном давлении (Ср) и постоянном объеме (Сv).
Для идеальных газов эти величины связаны уравнением:
Ср = Сv + R,
где R - газовая постоянная; R=8,31 Дж/моль×К.
Для расчета теплоемкостей газообразных веществ пользуются уравнениям
Сv = 3/2R (для одноатомных газов)
Cv = 5/2R (для двухатомных газов)
Сv = 6/2R или 7/2 (для трех и многоатомных газов)
Для расчета удельной теплоемкости сплавов, шлаков, стекол и растворов может быть использована приближенная формула
 , где q1, q2,......- массовые проценты соответствующих составных частей смеси; С1, С2,........- удельные теплоемкости составных частей смеси.
, где q1, q2,......- массовые проценты соответствующих составных частей смеси; С1, С2,........- удельные теплоемкости составных частей смеси.
Для расчета теплоты нагревания тела (вещества) от Т1 до Т2 можно воспользоваться уравнениями
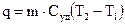 ,
,
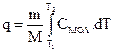 ,
,
где m - масса тела (вещества); М - молекулярная масса вещества; Суд, Смол - удельная и мольная теплоемкости вещества.
Теплоемкости используют в расчетах тепловых балансов работы печей, электролизеров и других металлургических агрегатов.
1.7. зависимость теплового эффекта от температуры
Тепловой эффект процесса слабо зависит от давления и может существенно изменяться с температурой.
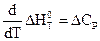 и
и 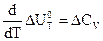 .
.
Эти термодинамические соотношения определяют температурную зависимость теплового эффекта химических реакций и являются дифференциальными выражениеми закона Кирхгофа, одна из формулировок которого гласит:
Температурный коэффициент теплового эффекта равен изменению теплоемкости системы (или разности сумм теплоемкостей продуктов реакции и исходных веществ), происходящему в результате процесса.
Согласно представленным уравнениям, влияние температуры на тепловой эффект обуславливается знаками величин 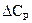 и
и 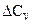 .
.
Проведем анализ зависимости (рис.4.):
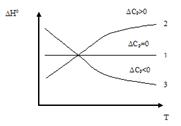
1)  ,
, 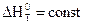 , таким образом, тепловой эффект процесса не зависит от температуры
, таким образом, тепловой эффект процесса не зависит от температуры 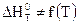 ;
;
2) 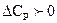 , в этом случае тепловой эффект процесса с ростом температуры увеличивается;
, в этом случае тепловой эффект процесса с ростом температуры увеличивается;
3) 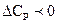 , в этом случае тепловой эффект процесса с ростом температуры уменьшается.
, в этом случае тепловой эффект процесса с ростом температуры уменьшается.
Однако, нам необходимо знать каков тепловой эффект процесса при данной, конкретной температуре.
Интегрируя уравнения Кирхгофа 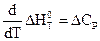 и
и 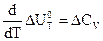 , получим выражения для расчета тепловых эффектов реакций при произвольных температурах:
, получим выражения для расчета тепловых эффектов реакций при произвольных температурах:
V = const:
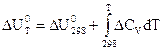
Р = const:
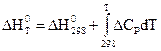 интегральная форма закона Кирхгофа
интегральная форма закона Кирхгофа
где 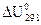 ,
, 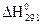 – тепловые эффекты, осуществляемые в стандартных условиях при V,Р = const, которые рассчитываются по закону Гесса с использованием стандартных теплот образования веществ.
– тепловые эффекты, осуществляемые в стандартных условиях при V,Р = const, которые рассчитываются по закону Гесса с использованием стандартных теплот образования веществ.
Если, например, 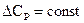 и величина отрицательная, то графически зависимость теплового эффекта от температуры имеет вид (рис.5.):
и величина отрицательная, то графически зависимость теплового эффекта от температуры имеет вид (рис.5.):
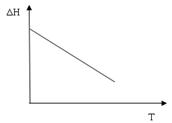 В общем случае тепловой эффект при постоянной теплоемкости можно определить из уравнения:
В общем случае тепловой эффект при постоянной теплоемкости можно определить из уравнения:
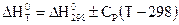
Часто при проведении расчетов возникает необходимость учета температурной зависимости теплоемкости компонентов реакции. Как правило, аналитическая форма функциональной зависимости C = f(T) неизвестна. В этом случае обычно используют эмпирические соотношения в виде степенных рядов для отдельных компонентов реакции С = a + bТ + gТn, а затем уже рассчитывается температурная зависимость теплоемкости химической реакции. Тогда, зависимость теплоемкости от температуры приводится к виду
 , где
, где 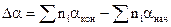 и т.д.
и т.д.
Подставляя это выражение в уравнения Кирхгофа, для стандартных условий, получим
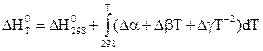 .
.
После интегрирования уравнение приводятся к виду:
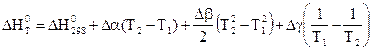 .
.
Если в рассматриваемом интервале температур имеют место фазовые переходы "твердое тело – жидкость", "жидкость – пар", то в уравнениях температурной зависимости теплового эффекта появляются дополнительные составляющие, учитывающие тепловые эффекты фазовых переходов:
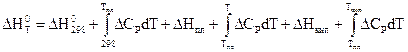 .
.
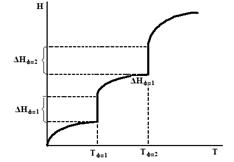
– изменения изохорной и изобарной теплоемкостей в соответствующих фазовых состояниях (твердом, жидком и газообразном). Температурная зависимость энтальпии, с учетом фазовых переходов, качественно показана на рис.6.
По величине 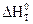 воспользовавшись соотношением Клаузиуса, можно рассчитать тепловой эффект процесса в изохорических условиях, т.е. при V=const:
воспользовавшись соотношением Клаузиуса, можно рассчитать тепловой эффект процесса в изохорических условиях, т.е. при V=const:  , где Dn – разность между числом молей газообразных веществ в конечном и начальном состояниях
, где Dn – разность между числом молей газообразных веществ в конечном и начальном состояниях 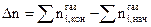 . (например, СО2+С=2СО; Dn=2-1=1.
. (например, СО2+С=2СО; Dn=2-1=1.
При Dn=0, 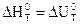 .
.
Date: 2015-05-09; view: 4066; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |