
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая Термодинамика
Введение
Ф/х возникла в середине 19 столетия, когда накопленные знания в таких дисциплинах, как физика и химия, позволили выделиться физической химии в самостоятельную дисциплину, которая изучает химические явления (или химические процессы) с помощью законов физики. Связано это с тем, что физические и химические процессы взаимосвязаны. Так, например, химические процессы сопровождаются и инициируются физическими. Соответственно механизм химических процессов может быть понят лишь на основе физических теорий, описывающих движение реагирующих молекул и осуществляющих акт химической реакции электронов. С другой стороны, физические свойства тел существенно зависят от их химического состава.
Впервые определение физической химии, как науки, дал Михаил Васильевич Ломоносов: «Физическая химия - наука, которая должна на основании положений и опытов физических объяснить причину того, что происходит через химические операции в сложных телах».
Ф/х – наука о закономерностях химических процессов и сопутствующих им физических явлений. Она объясняет эти явления на основе фундаментальных положений физики и стремится к количественному описанию химических процессов. Позволяет предсказать возможности протекания процессов и предел, до которого в данных условиях эти процессы могут быть реализованы.
Объектами ее изучения являются системы, в которых могут протекать химические превращения.
химическая Термодинамика
Термодинамика возникла в первой половине 19 века. В первый период своего развития она изучала соотношения только между теплотой и механической работой, т.е. между количеством теплоты, принимаемым или отдаваемым участвующими в процессе телами, и количеством работы, которая может быть получена в результате этих процессов при тех или иных условиях протекания. Все эти вопросы возникали в связи с изобретением и все большим распространением паровых машин. Отсюда и название этого раздела физической химии (от двух греческих слов: термо- теплота; динамис – движение, работа, сила). Позднее с открытием и исследованием электрической, лучистой, химической и других форм энергии постепенно круг рассматриваемых термодинамикой вопросов расширяется.
Термодинамика – наука, изучающая взаимные переходы теплоты и работы в равновесных системах и при переходе к равновесию.
С помощью химической термодинамики решаются следующие задачи:
- выяснение возможности самопроизвольного протекания химической реакции или фазового превращения при определенных условиях;
- установление условий, при которых реагирующие вещества и продукты реакции будут находиться в равновесии;
- определение энергетических эффектов (количеств теплоты и работы), которые сопровождают химические реакции и фазовые превращения.
Кроме того, термодинамика позволяет найти выход продуктов реакции (сколько получим в результате реализации процесса и степень превращения исходных веществ).
1.1. Основные определения и понятия термодинамики
Объект изучения термодинамики – термодинамическая система – тело или группа тел, выделенных из внешней среды с помощью реально существующих или условных границ. По характеру энерго- и массообмена вещества с окружающей средой, термодинамические системы подразделяются:
открытые;
закрытые;
изолированные.
Иизолированные системы – полностью отсутствует энерго- и массообмен с внешней средой., т.е. объем и энергия постоянны.
Условно их можно представить как идеально термостатированные объекты с абсолютно непроницаемыми граничными поверхностями.
В реальных условиях любое тело в той или иной степени обменивается энергией с внешней средой, взаимодействуя с ней посредством теплового, материального и механического контактов (либо в совокупности, либо в различных сочетаниях). Поэтому понятие изолированной системы является физической абстракцией и не имеет место в реальной действительности.
Закрытые системы – системы, в которых существует обмен энергией с окружающей средой, но нет обмена веществом.
Примером подобной системы, весьма близким к реальности, является космический корабль, материально изолированный от среды, но обменивающийся с ней энергией (отдает энергию за счет неидеальной теплоизоляции корпуса и получает при преобразовании лучистой энергии в электрическую в солнечных батареях).
Открытые системы – способны обмениваться веществом и энергией с внешней средой.
Большинство реальных систем окружающего нас мира относятся к открытым системам, в том числе и большинство металлургических процессов.
По фазовому состоянию системы бывают твердыми, жидкими и газообразными (парообразными) или представляют собой сочетание веществ в различных фазовых состояниях.
Фаза – это совокупность однородных частей системы, имеющих одинаковые физико-химические свойства и отделенных от других частей системы границами раздела. По числу фаз термодинамические системы подразделяются на: однофазные, двухфазные, трехфазные и многофазные.
Системы бывают гомогенные – системы, в которых все химические и физические свойства одинаковы во всех частях или непрерывно изменяются по всему объему (состоят из одной фазы);
гетерогенные – системы, имеющие внутренние границы раздела, на которых происходит скачкообразное изменение свойств (или иначе, состоят из нескольких фаз).
Состояние любой термодинамической системы может быть охарактеризовано с помощью термодинамических переменных. Их условно делят на:
- независимые переменные (исходные переменные, которые выбраны, чтобы представлять состояние системы: Т, Р,V, n, q, A)
- термодинамические функции (все другие свойства (параметры), которые могут быть выражены через независимые переменные)
Различают термодинамические переменные:
Внешние, которые определяются свойствами и координатами тел в окружающей среде и зависят от контактов системы с окружением (например, объем, напряженность силовых полей)
Внутренние, которые зависят только от свойств самой системы (например, плотность, внутренняя энергия)
Экстенсивные, которые зависят от массы системы или числа частиц (например, объем, внутренняя энергия, энтропия, теплоемкость)
Интенсивные, которые не зависят от массы системы или числа частиц (температура, плотность, давление). Отношение любых двух экстенсивных переменных является интенсивным параметром, (например, отношение массы к объему (экстенсивные параметры) дает плотность (интенсивный параметр).
Параметры связаны между собой определенными математическими уравнениями – уравнениями состояния.
Например, для идеального газа существует уравнение связи между параметрами:
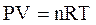 -уравнение Клапейрона-Менделеева,
-уравнение Клапейрона-Менделеева,
где Р – давление, V - объем, n - количество молей идеального газа, Т – абсолютная температура. R - коэффициент пропорциональности, который называется универсальной газовой постоянной. В физической химии обычно используется величина R, равная 8,314·Дж/моль К. Физический смысл универсальной газовой постоянной – работа, которую совершает 1 моль газа при увеличении температуры на 1 К.
Общее уравнение состояния термодинамических систем имеет вид ¦(P,T,V)=0. Для большинства реальных систем связи между параметрами состояния сложны и часто не могут быть представлены в аналитическом виде. Поэтому при выполнении термодинамических расчетов с реальными веществами на практике пользуются таблицами и диаграммами состояния, построенными на основании экспериментального изучения свойств веществ.
Изменение одного параметра влечет за собой закономерные изменения других параметров в соответствии с уравнением состояния, что вызывает термодинамический процесс.
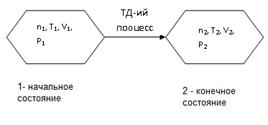
Термодинамика изучает начальное и конечное состояния системы и делает вывод о термодинамическом процессе.
В зависимости от того, какие параметры системы остаются постоянными при изменении других, процессы бывают: изотермическими (Т=const), изобарический (P=const), изохорическими (V=const), адиабатическими (q = const), изохорно-изотермическими (V,T=const), все реальные процессы протекают в изобарно-изотермических условиях (P,T=const).
Кроме того, все процессы делятся на:
- эндотермические – протекающие с поглощением тепла;
- экзотермические – протекающие с выделением тепла;
Обратимый процесс – процесс, после протекания которого система возвращается в исходное состояние без оставления каких либо следов в окружающей среде.
Процесс необратимый - после протекания такого процесса система возвращается к исходному состоянию и оставляет след в окружающей среде (например, выделяет в него энергию или поглощает ее).
- самопроизвольный процесс – процесс, протекающий без внешнего воздействия, т.е. для осуществления которых не надо затрачивать энергию извне.
- несамопроизвольный процесс – процесс, происходящий при затрате энергии.
- равновесный процесс – процесс, при котором система проходит через непрерывный ряд равновесных состояний (равновесное состояние – это состояние когда характеристики системы постоянны и в ней нет потоков вещества или энергии).
1.2. ВНУТРЕННЯЯ ЭНЕРГИЯ, теплота, работа
Любая материальная система состоит из множества частиц различной природы (атомов, молекул, ионов и т. п.), находящихся в непрерывном движении. Количественной характеристикой движения, а, соответственно, и материальных систем, является энергия.
Энергия Е любой термодинамической системы включает в себя следующие составляющие:
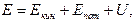
где 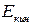 – макроскопическая кинетическая энергия системы как целого;
– макроскопическая кинетическая энергия системы как целого; 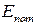 – потенциальная энергия системы во внешних силовых полях;
– потенциальная энергия системы во внешних силовых полях; 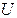 – внутренняя энергия системы.
– внутренняя энергия системы.
Величины 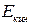 и
и 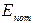 определяются так же, как и в механике.
определяются так же, как и в механике.
Важнейшая характеристика термодинамических систем внутренняя энергия – 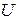 , определяется их внутренним состоянием и является функцией термодинамических параметров.
, определяется их внутренним состоянием и является функцией термодинамических параметров.
По определению Клаузиуса
Date: 2015-05-09; view: 1125; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |