
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

При расчетах DS системы следует не забывать, что энтропии веществ - величины экстенсивные, т.е. зависящие от массы
2.2 применение II закона термодинамика для неизолированных систем
Многие процессы химической технологии протекают при постоянном давлении и температуре, если они проводятся в открытых аппаратах, или при постоянном объеме и температуре, если они проводятся в закрытых аппаратах, например, в автоклавах. В химической технологии о направлении процесса и равновесии в системе при постоянных давлении и температуре судят по энергии Гиббса или при постоянных объеме и температуре — по энергии Гельмгольца. Это связано с тем, что на практике рассмотрение изолированных систем и использование 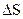 в качестве критерия равновесия и направления процесса крайне неудобно, так как рассмотрение изолированной системы часто встречает большие затруднения.
в качестве критерия равновесия и направления процесса крайне неудобно, так как рассмотрение изолированной системы часто встречает большие затруднения.
Изохорно-изотермические условия (V=const, T=const)
по уравнению Гиббса - Гельмгольца
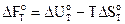 .
.
При 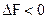 - самопроизвольный процесс возможен в прямом направлении; при
- самопроизвольный процесс возможен в прямом направлении; при 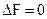 система находится в состоянии равновесия; при
система находится в состоянии равновесия; при  самопроизвольный процесс в прямом направлении невозможен, возможен обратный процесс. Таким образом, если в системе, находящейся при Т и V = const, происходит какой-либо неравновесный самопроизвольный процесс, то энергия Гельмгольца уменьшается до тех пор, пока система не достигнет равновесия.
самопроизвольный процесс в прямом направлении невозможен, возможен обратный процесс. Таким образом, если в системе, находящейся при Т и V = const, происходит какой-либо неравновесный самопроизвольный процесс, то энергия Гельмгольца уменьшается до тех пор, пока система не достигнет равновесия.
Изобарно-изотермические условия (Р=const, T=const)
по уравнению Гиббса - Гельмгольца
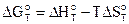 .
.
При 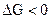 - самопроизвольный процесс возможен в прямом направлении; при
- самопроизвольный процесс возможен в прямом направлении; при 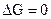 система находится в состоянии равновесия; при
система находится в состоянии равновесия; при 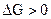 самопроизвольный процесс в прямом направлении невозможен, возможен обратный процесс. Таким образом, если в системе, находящейся при Т и V = const, происходит какой-либо неравновесный самопроизвольный процесс, то энергия Гельмгольца уменьшается до тех пор, пока система не достигнет равновесия.
самопроизвольный процесс в прямом направлении невозможен, возможен обратный процесс. Таким образом, если в системе, находящейся при Т и V = const, происходит какой-либо неравновесный самопроизвольный процесс, то энергия Гельмгольца уменьшается до тех пор, пока система не достигнет равновесия.
Date: 2015-05-09; view: 598; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |