
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электродные потенциалы. Гальванические элементы
Пример 1. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого:
Ni │ NiSO4 ║ CoSO4 │ Co
(0,001 M) (1 M)
(В скобках приведены молярные концентрации растворов соответствующих солей). Вычислите величину электродвижущей силы (ЭДС) гальванического элемента.
Решение. Рассчитаем величины электродных потенциалов по уравнению Нернста:
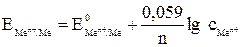 ,
,
где  – стандартный электродный потенциал (см. в Приложении: табл. 6;
– стандартный электродный потенциал (см. в Приложении: табл. 6; 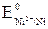 = –0,25 В;
= –0,25 В; 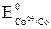 = –0,28 В).
= –0,28 В).
 = –0,25 +
= –0,25 +  ·(–3) = –0,34 В.
·(–3) = –0,34 В.
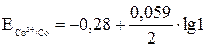 = –0,28 +
= –0,28 +  ·0 = –0,28 В.
·0 = –0,28 В.
На электроде, имеющем меньший потенциал, происходит отдача электронов, т. е. окисление. Этот электрод называется анодом. Поскольку 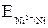 <
< 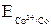 , анодом является никелевый электрод.
, анодом является никелевый электрод.
На электроде, имеющем больший потенциал, происходит принятие электронов, т. е. восстановление. Этот электрод называется катодом. Им является кобальтовый электрод.
Процессы, протекающие в гальваническом элементе:
Анод Ni – 2  = Ni2+
= Ni2+
Катод Co2+ + 2  = Co
= Co
Ионно-молекулярное уравнение: Ni + Co2+ = Ni2+ + Co
Молекулярное уравнение: Ni + CoSO4 = NiSO4 + Co
ЭДС = E(к) – E(а) = –0,28 – (–0,34) = 0,06 В.
Пример 2. В каком направлении может самопроизвольно протекать реакция
2Bi + 3CdCl2  2BiCl3 + 3Cd
2BiCl3 + 3Cd
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1  .
.
Решение. Окислительно-восстановительная реакция возможна, если потенциал предполагаемого окислителя больше потенциала предполагаемого восстановителя: Eокисл > Eвосст. Для прямой реакции



окислителем должен являться ион Cd2+, а восстановителем – металлический висмут 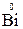 . Однако соотношение их электродных потенциалов:
. Однако соотношение их электродных потенциалов: 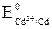 = –0,40 В <
= –0,40 В <  = +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
= +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
Для обратной реакции окислителем оказывается ион Bi3+, а восстановителем – металлический кадмий 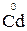 , т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
, т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
2BiCl3 + 3Cd = 2Bi + 3CdCl2
В гальваническом элементе на аноде (Cd) протекает процесс окисления кадмия, а на катоде (Bi) – процесс восстановления ионов Bi3+:
Анод Cd – 2 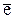 = Cd2+ │ 3
= Cd2+ │ 3
Катод Bi3+ + 3 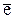 = Bi │ 2
= Bi │ 2
2Bi3+ + 3Cd = 2Bi + 3Cd2+
Схема гальванического элемента:
(А) Cd │ CdCl2 ║ BiCl3 │ Bi (К)
ЭДС = E(к) – E(а) =  –
– 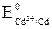 = +0,22 – (–0,40) = 0,62 В.
= +0,22 – (–0,40) = 0,62 В.
Date: 2015-09-24; view: 730; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |