
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коррозия и защита металлов
Пример 1. Возможна ли коррозия сплава, состоящего из мелкодисперсных кристаллов висмута и свинца: а) в аэрируемой воде; б) в изолированном от воздуха сосуде с водой? Для среды, в которой коррозия возможна, составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии.
Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Eокисл > Eвосст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является свинец ( = –0,13 В <
= –0,13 В <  = +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.
= +0,22 В). Окислителем будут те ионы или молекулы в окружающей среде, которые имеют больший потенциал.
а) В аэрируемой воде из двух возможных окислителей – иона водорода воды H+ и растворенного в воде кислорода O2 – более сильным окислителем является кислород, так как его потенциал больше (в нейтральной среде 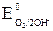 = +0,81 В >
= +0,81 В > 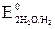 = –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
= –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
Схема гальванического элемента: Pb | O2; H2O | Bi. Анодом является свинец, катодом – висмут. Протекают процессы:
Анод Pb – 2 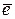 = Pb2+ │ 2
= Pb2+ │ 2
Катод O2 + 4 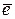 + 2H2O = 4OH– │ 1
+ 2H2O = 4OH– │ 1
2Pb + O2 + 2H2O = 2Pb(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид свинца Pb(OH)2.
б) В отсутствие кислорода единственным окислителем могли бы быть ионы водорода из воды. Но поскольку Eокисл = –0,41 В < Eвосст = –0,13 В, коррозия невозможна.
Пример 2. Какие процессы будут протекать при коррозии бериллия и меди, находящихся в контакте? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в следующих средах: а) во влажном воздухе; б) в растворе гидроксида натрия; в) в растворе хлороводородной кислоты.
Решение. Из контактирующих металлов более активным восстановителем является бериллий, так как  = –1,85 В <
= –1,85 В < 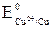 = +0,34 В, поэтому, в первую очередь, корродирует бериллий.
= +0,34 В, поэтому, в первую очередь, корродирует бериллий.
а) Во влажном воздухе окислителем является кислород. Коррозия возможна, так как его потенциал значительно больше потенциала бериллия. Бериллий будет являться анодом и окисляться, а медь – катодом, где будет восстанавливаться кислород:
Анод Be – 2 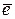 = Be2+ │ 2
= Be2+ │ 2
Катод O2 + 4 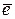 + 2H2O = 4OH– │ 1
+ 2H2O = 4OH– │ 1
2Be + O2 + 2H2O = 2Be(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид бериллия.
б) Поскольку гидроксид бериллия амфотерен, в щелочном растворе процесс анодного окисления бериллия заканчивается образованием гидроксокомплекса:
Анод Be – 2 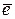 + 4OH– = [Be(OH)4]2–
+ 4OH– = [Be(OH)4]2–
Несмотря на то, что потенциал кислорода больше, чем иона водорода воды, доступ кислорода к поверхности катода (медь) ограничен из-за малой его растворимости и медленной диффузии. Поэтому в щелочном растворе (pH 14) при условии 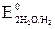 = –0,82 В >>
= –0,82 В >>  = –1,85 В, окислителем является ион водорода воды
= –1,85 В, окислителем является ион водорода воды
Катод 2H2O + 2 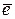 = H2 + 2OH–
= H2 + 2OH–
Результирующее уравнение процесса коррозии получим, суммируя уравнения анодного и катодного процессов:
Be + 2H2O + 2OH– = [Be(OH)4]2– + H2
или
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2
в) По тем же кинетическим причинам, что и в предыдущем случае, окислителем является ион водорода H+. Уравнения процессов:
Анод Be – 2 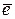 = Be2+
= Be2+
Катод H2 + 2 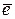 = H2
= H2
Be + 2H2 = Be2+ + H2
или
Be + 2HCl = BeCl2 + H2
Date: 2015-09-24; view: 623; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |