
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Причины электрохимической коррозии
Основной причиной коррозии металлов, в том числе и электрохимической, является их термодинамическая неустойчивость.
Коррозионный процесс протекает в том случае, если он сопровождается убылью изобарного потенциала, когда
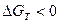 , то есть
, то есть  ,
,
где D G Т ─ изменение изобарного потенциала данного коррозионного процесса при температуре Т (К), Дж / моль;
z ─ число моль-эквивалентов;
F ─ число Фарадея (F = 96500), Кл / моль-экв;
j г ─ э.д.с. гальванического элемента, в котором обратимо происходит данный коррозионный процесс при температуре Т К, В;
j к ─ обратимый (равновесный) потенциал катодной реакции, В;
j а ─ обратимый (равновесный) потенциал анодной реакции, В.
Самопроизвольное протекание электрохимического коррозион-ного процесса возможно, если
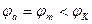 ,
,
где j м ─ обратимый (равновесный) потенциал металла, В.
Следовательно, для электрохимического растворения металла необходимо присутствие в электролите окислителя-деполяризатора, равновесный окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. При соблюдении этого условия
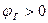 и
и 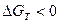 .
.
Современная теория электрохимической коррозии металлов исходит из возможности протекания процесса как гомогенно-электрохимическим, так и гетерогенно-электрохимическим путем, из которых второй в практических случаях преобладает.
Протекание электрохимической коррозии металлов по гомо-генному механизму характеризуется одинаковой скоростью проте-кающих на поверхности металла электрохимических реакций и одинаковым значением потенциала во всех точках поверхности. В этом случае анодный и катодный процессы могут протекать на одном и том же участке поверхности, чередуясь во времени. Этот гомогенный путь протекания электрохимической коррозии металлов может иметь преобладающее значение при растворении ртути, амальгам и особо чистых жидких металлов.
Даже если твердый металл химически вполне однороден, разные точки его поверхности отличаются своим положением в решетке отдельных кристаллитов, обладают различной энергией и различными свойствами, что отражается на кинетике электрохимических реакций, протекающих в этих точках. На поверхности металла, имеющего инородные включения, имеются отделенные участки с различными физическими и химическими свойствами и процесс электрохими-ческой коррозии протекает по гетерогенному механизму.
Согласно гетерогенной трактовке процессов электрохимической коррозии (теории локальных элементов) участки катодной и анодной реакции разделены и для протекания коррозии необходим переток электронов в металле и ионов в электролите (рисунок 1).
Раствор
АZ- AZ-
MZ+ H+ H+ H2

Анод е
М - ze Примеси
Металл (Катод)
АZ- ─ анион кислоты; МZ+ ─ катион металла
Рисунок 1 ─ Схема коррозии металла в растворе кислоты с выделением водорода
Такое пространственное разделение анодной и катодной реакций энергетически более выгодно, так как они локализуются на тех участках, где их прохождение облегчено. Локализация катодного и анодного процессов на различных участках корродирующей поверх-ности металла приводит к неравномерному или местному характеру коррозионного разрушения. Эти отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходит анодный или катодный процессы, являются, в зависимости от их размеров, короткозамкнутыми макрогальвани-ческими (имеющими размеры, хорошо различимые невооруженным глазом) или микрогальваническими (обнаруживаемыми только при помощи микроскопа) элементами.
Таким образом, электрохимическая коррозия металлов напоми-нает работу гальванического (химического) элемента, в котором отрицательный электрод (например, цинк) растворяется, когда он соединен проводником со вторым электродом, на котором восс-танавливаются ионы водорода, молекулы кислорода или другие вещества и поэтому электрохимическую коррозию можно рассмат-ривать как результат работы большого числа коррозионных галь-ванических элементов на корродирующей поверхности металла. Приведем несколько примеров возникновения работы коррозионных гальванопар.
Пример 1. При погружении пластинок из цинка и меди в раствор кислоты возникает макрогальванический элемент, который можно изобразить схемой
(-) Zn ½ H+ ½ Cu (+)
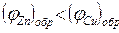
Анодный процесс
Zn + nH2O ® Zn2+ × nH2O + 2e
Катодный процесс протекает с водородной деполяризацией
2Н+ + 2е ® Н2
Цинк подвергается разрушению, на медном электроде разря-жаются ионы водорода и выделяется газообразный водород.
Пример 2. Поверхность серого чугуна в растворе электролита с рН ³ 7 можно рассматривать как множество микрогальванопар, образованных железом и графитом, которые можно записать схемой
(-) Fe ½ H2O, O2 ½ Cгр. (+)
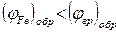
Анодный процесс
Fe + mH2O ® Fe2+ × mH2O + 2e
Катодный процесс протекает с кислородной деполяризацией:
О2 + 2Н2О + 4е ® 4ОН-
Между продуктами катодной и анодной реакций протекают вторичные процессы:
Fe2+ + ОН- ® Fe(ОН)2
Гидроксид железа (II) ─ окисляется кислородом воздуха в при-сутствии воды
4Fe(OH)2 + O2 + 2H2O ® 4Fe(OH)3
Образуется продукт коррозии ─ гидроксид железа (III) Fe(OH)3, который переходит в ржавчину mFe2O3 × nH2O.
Date: 2015-09-27; view: 658; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |