
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основания
Основания - сложные хим. соединения, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид – анионы ОН-).
Классификация.
Основания бывают:
растворимые в воде (щёлочи) и нерастворимые (см. табл. растворимости).
по количеству ОН-групп:
однокислотные (NaOH) и многокислотные (Ba(OH)2, Fe(OH)3)
Номенклатура.
Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, NаОН - гидроксид натрия, КОН - гидроксид калия, Са(ОН)2 - гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe(ОН) 2 - гидроксид железа (II), Fe(ОН)3 - гидроксид железа (III).
Помимо этих названий, для некоторых наиболее важных оснований применяются и другие (технические, тривиальные). Например, гидроксид натрия NaОН называют едкий натр; гидроксид калия КОН - едкое кали; гидроксид кальция Са(ОН)2 - гашеная известь; гидроксид бария Ва(ОН)2 - едкий барит.
Получение
1. Реакции активных металлов (щелочных и щелочноземельных) с водой:
2Na + 2H2O ® 2NaOH + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей:
2NaCl + 2H2O 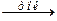 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
4. Нерастворимые в воде основания можно получить реакцией ионного обмена:
NiCl2 + 2NaOH ® Ni(OH)2↓ + 2NaCl
Date: 2015-09-18; view: 290; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |