
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Средние соли
Важнейшие способы получения средних солей в виде схемы представлены на рис. 1. Жирными линиями соединены классы неорг. веществ, представители которых, реагируя, образуют соли.
Не все эти способы применимы к каждой соли, например: соли бескислородных кислот нельзя получить, используя способы 3 и 5, а соли металлов, стоящих в ряду напряжений правее водорода нельзя получить, используя способ 2. И наоборот, существует множество способов получения отдельных солей, не включенных в этот перечень. Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
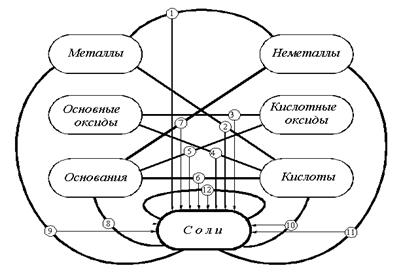
Рис.1. Способы получения средних солей.
Таким образом, соли можно получить 12 важнейшими способами:
1) при взаимодействии металлов с неметаллами:
2Na + Cl2 ® 2NaCl
2) при взаимодействии металлов с кислотами:
Zn + 2HCl ® ZnCl2 + H2
3) при взаимодействии основных оксидов с кислотными оксидами:
MgO + CO2 ® MgCO3
4) при взаимодействии основных оксидов с кислотами:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
5) при взаимодействии кислотных оксидов с основаниями:
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
6) при взаимодействии оснований с кислотами:
Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
7) при взаимодействии неметаллов с основаниями:
2KOHконц + Cl2 ® KClр-р + KClOр-р + H2O.
8) при взаимодействии оснований с солями:
Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
9) при взаимодействии металлов с солями:
Fe + CuSO4 ® FeSO4 + Cu
10) при взаимодействии кислот с солями:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
11) при взаимодействии неметаллов с солями:
2K2SO3 + O2 ® 2K2SO4 (в растворе, медленно);
12) при взаимодействии солей друг с другом:
3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Date: 2015-09-18; view: 414; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |