
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ароматичний характер п'ятичленних гетероциклів з одним гетероатомом. Реакції SE фурану, піролу та тіофену. Ацидофобність фурану і піролу
Пятичленные ароматические гетероциклы пиррол, фуран и тиофен. Все три гетероцикла генетически связаны друг с другом. Как показал Ю. К. Юрьев, переходы между ними осуществляются при температуре около 400С в присутствии оксида алюминия (катализатор).
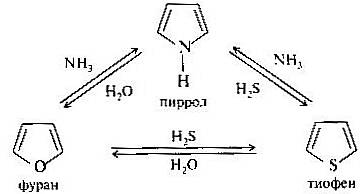
Пиррол, фуран и тиофен относятся к так называемым пи-избыточным гетероциклам, т. е. соединениям с повышенной электронной плотностью внутри кольца. Поэтому они обладают повышенной склонностью вступать в реакции электрофильного замещения по сравнению с бензолом и легко окисляются.
1. Пиррол. Этот представитель азотсодержащих гетероциклических соединений с одним гетероатомом азота наиболее важен среди пятичленных ароматических гетероциклов. Пиррол представляет собой бесцветную жидкость (т. кип. 131 °С), практически нерастворимую в воде, быстро темнеющую на воздухе. В пирроле и других гетероциклических соединениях атомы углерода, находящиеся рядом с гетероатомом, обозначают буквой альфа, а более удаленные — бета. Ароматичность пиррола, как и бензола, обусловлена наличием плоской шестиэлектронной пи-системы: по одному электрону от четырех sр2-гибридизованных атомов углерода и еще два пи-электрона sр2-гибридизованного, пиррольного, атома азота. Эта неподеленная пара электронов является частью ароматического секстета и поэтому не проявляет склонности к связыванию протона. В результате пиррол практически лишен основных свойств. Напротив, при взаимодействии с натрием, калием, амидом натрия NН-группа пиррола проявляет кислотный характер. Получающиеся соли — пиррол-натрий или пиррол-калий — разлагаются водой, образуя исходный пиррол и гидроксид щелочного металла. Пиррол является ацидофобным, т. е. не выдерживающим присутствия кислот, соединением. Обработка пиррола минеральными кислотами приводит к образованию темной густой смолы. Ацидофобность пиррола учитывается привыборе реагентов для реакций электрофильного замещения, так как большинство электрофильных реагентов представляет собой кислоты или потенциальные кислоты. Обычно электрофильное замещение в пирроле осуществляют, проводя реакции в щелочной среде или используя комплексы электрофильных реагентов с основаниями, такими, как пиридин. Наибольшую реакционную способность в пирроле проявляет альфа-положение. Если оно занято, то заместитель вступает в бета-положение. Восстановление пиррола требует применения достаточно сильных восстановителей и протекает ступенчато.
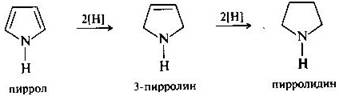
Конечный продукт восстановления пирролидин (циклический вторичный амин) обладает сильными основными свойствами. Его ядро входит в состав ряда природных соединений, лекарственных средств, некоторых алкалоидов, альфа-аминокислот пролина и гидроксипролина, а также производных пирролидона-2 — лактама гамма-аминомасляной кислоты.
2. Фуран. Этот пятичленный кислородсодержащий гетероцикл и его производные напоминают соединения пиррольного ряда. Фуран ацидофобен и, подобно пирролу, при действии минеральных кислот подвергается полимеризации с раскрытием цикла, что сопровождается смолообразованием. При действии подходящих электрофильных реагентов фуран легко вступает в реакции электрофильного замещения — нитруется ацетилнитратом в пиридине и сульфируется пиридинсульфотриоксидом. Заместитель при этом вступает в альфа-положение. Фуран может присоединять водород в присутствии никелевого катализатора с образованием тетрагидрофурана. Последний широко используется в качестве растворителя, а также исходного соединения для получения 1,4-дибромобутана, а через него динитрила гександиовой кислоты в производстве нейлона.
3. Тиофен. Из рассматриваемых пятичленных гетероциклических соединений с одним гетероатомом тиофен наиболее близок к бензолу по химическим и физическим свойствам (т. кип. тиофена 84С, бензола 80С). Тиофен содержится в каменноугольной смоле. В реакциях электрофильного замещения тиофен менее активен, чем пиррол и фуран, и гораздо более стоек к действию минеральных кислот. Так, тиофен сульфируется непосредственно серной кислотой с образованием тиофен-2-сульфокислоты; легко нитруется, давая 2-нитротиофен; ацилируется в присутствии кислот Льюиса, что ведет к получению альфа-тиенилкетонов. Восстановление тиофена приводит к тетрагидротиофену.
4. Пиридин и его гомологи. Пиридин представляет собой бесцветную жидкость (т. кип. 115°С), хорошо смешивающуюся с водой и органическими растворителями; имеет характерный неприятный запах; весьма ядовит. Вдыхание его паров можетпривести к тяжелому поражению нервной системы. В небольших количествах пиридин и его гомологи присутствуют в каменноугольной смоле. Пиридин — ароматическое гетероциклическое соединение, обладающее основными свойствами. Если в пирроле атом азота предоставляет пару р-электронов для образования ароматического секстета и тем самым повышает электронную плотность в цикле, то в пиридине sр2-гибридизованный атом азота, напротив, проявляет электроноакцепторный характер. Атом азота более электроотрицателен, чем атом углерода. Поэтому замена группы =СН- в бензоле на изоэлектронный атом азота приводит к тому, что система пиридина по сравнению с бензолом оказывается электронодефицитной. В результате пиридин труднее вступает в реакции электрофильного замещения, труднее окисляется, но легче гидрируется. Гомологи пиридина легко окисляются в соответствующие пиридинкарбоновые кислоты, при этом пиридиновый цикл не затрагивается. Важное значение имеет окисление изомерных метилпиридинов, пиколинов. Так, бета-пиколин превращается в бета-пиридинкарбоновую, никотиновую, кислоту.
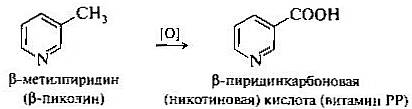
В пиридине неподеленная пара электронов атома азота не принимает участия в образовании пи-электронного секстета и, следовательно, ответственна за проявление его основных свойств. Водные растворы пиридина окрашивают лакмус в синий цвет; при действии минеральных кислот образуются кристаллические пиридиниевые соли. С кислотами Льюиса пиридин образует донорно-акцепторные комплексы, примером которых может служить комплекс с триоксидом серы пиридинсульфотриоксид — С5Н5N*SO3, применяемый для сульфирования пятичленных гетероциклов. Основность пиридина значительно меньше основности алифатических аминов. Это связано с тем, что неподеленная пара электронов атома азота занимает sр2-гибридную орбиталь. Атом азота в пиридине более электроотрицателен, чем sрЗ-гибридизованный атом азота в обычных аминах и, следовательно, прочнее удерживает свою электронную пару.
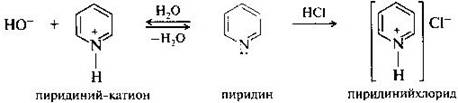
Атом азота в пиридине проявляет нуклеофильные свойства, например в реакциях с алкилгалогенидами. При этом получают четвертичные алкилпиридиниевые соли.
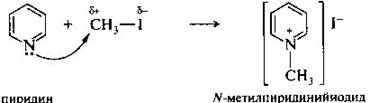
В таких солях за счет положительно заряженного атома азота гетероциклическое кольцо пиридина становится еще более электронодефицитным и поэтому более восприимчивым к нуклеофильной атаке. В частности, действие сильного нуклеофила гидрид-иона на N-метилпиридиний-катион приводит к его восстановлению в 1,4-дигидро-N-метилпиридин.
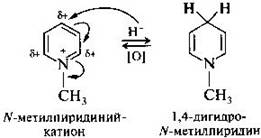
В 1,4-дигидрометилпиридине ароматичность нарушена, поэтому его молекула нестабильна и стремится за счет обратной реакции окисления вновь перейти в ароматическое состояние. Эти реакции окисления—восстановления моделируют действие важного кофермента НАД, в состав которого входит замещенный катион пиридиния. Восстановление пиридина протекает в более мягких условиях, чем восстановление бензола. Так, пиридин легко гидрируется водородом, образующимся при взаимодействии натрия с этанолом или водородом в присутствии никелевого катализатора. В результате получается гексагидропиридин — пиперидин.
Date: 2015-07-27; view: 2533; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |