
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Литературный обзор
1.1 Способы получения
1 способ
Проходит в две стадии: первая – окисление толуола, который окисляется в бензойную кислоту; вторая – нитрование бензойной кислоты. Так как группа СООН является мето-ориентантом то группа NO3 идет в мето-положение:





 [O] + HNO3
[O] + HNO3

 – CH3 – COOH – COOH
– CH3 – COOH – COOH
/
NO2
Реакция нитрования идет в присутствии концентрированной серной кислоты.
2 способ
Взаимодействие хлорбензойной кислоты с нитратом серебра



 AgNO3
AgNO3
 – CH3 – COOH + AgCl
– CH3 – COOH + AgCl
/
NO2
1.2 Химические свойства
1.2.1 Бензойная кислота
Бензойная кислота дает все основные реакции карбоновых кислот.
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: электронная плотность смещена в сторону наиболее электроноакцепторного атома – кислорода:
d –
// О
– С d+
\ О – Н
Это ослабляет связь между кислородом и водородом и облегчает отделение иона водорода и облегчает отделение иона водорода, т.е. диссоциацию кислоты:
 R – COOH R – COO – + H +
R – COOH R – COO – + H +
С участием карбоксильной группы кислоты образуют ряд производных: соли, галогенангедриды, сложные эфиры, амиды, нитрилы и т.д.
1.2.1.1 Образование солей
Обладая кислым характером, бензойная кислота образует соли при действии активного металла, основного оксида, основания или соли слабых кислот, аммиака или аминов:
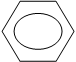 | 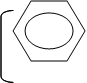 | ||||
 | |||||
 – COOH + Mg – COO – Mg + H2
– COOH + Mg – COO – Mg + H2
 |  |




 – COOH + CaO – COO – Ca + H2O
– COOH + CaO – COO – Ca + H2O




 – COOH + NaOH – CO – ONa + H2O
– COOH + NaOH – CO – ONa + H2O




 – COOH + NaHCO3 – CO – ONa + H2O + CO2
– COOH + NaHCO3 – CO – ONa + H2O + CO2
1.2.1.2 Восстановление
При действии восстановителей в присутствии катализаторов бензойная кислота восстанавливается до спиртов:



 LiAlH4
LiAlH4
 – COOH – CH2OH
– COOH – CH2OH
1.2.1.3 Реакция этерификации
Со спиртом бензойная кислота дает сложный эфир:




 H +
H +
– COOH + C2H5OH – CO – OC2H5 + H2O
Если заместителей в орто-положении нет, то этерификация карбоксильной группы происходит так же легко, как в случае алифатических кислот. Если одно из орто-положений замещено, скорость этерификации сильно уменьшается, а если оба орто-положения заняты, этерификация обычно не идет.
1.2.1.4 Действие галогенирующих агентов
Хлорангидрид бензойной кислоты получают действием хлорида фосфора (V) на кислоту:
 |  |
 – COOH + PCl5 – CO – Cl + POCl3 + HCl
– COOH + PCl5 – CO – Cl + POCl3 + HCl
Хлорангидрид может быть получен также действием на бензойную кислоту хлористого тионила:
 |  |
 – COOH + SOCl2 – CO – Cl + SO2 + HCl
– COOH + SOCl2 – CO – Cl + SO2 + HCl
1.2.1.5 Образование ангидридов
Ангидрид бензойной кислоты получаются действием водоотнимаюших средств:
 |  | ||||
 | |||||
 2 – COOH + P2O5 – CO – O + 2HPO3
2 – COOH + P2O5 – CO – O + 2HPO3
1.2.1.6 Образование амидов
Реакция бензойной кислоты с аммиаком приводит к образованию амидов:
 |  |
 – COOH + NH3 – CO – NH2 + HCl
– COOH + NH3 – CO – NH2 + HCl
1.2.1.7 Реакция электрофильного замещения
Так как карбоксильная группа является ориентантом второго рода, электрофильное замещение у бензойной кислоты проходит в мета-положение и весьма трудно:



 t0
t0
 – COOH + HNO3 – COOH + H2O
– COOH + HNO3 – COOH + H2O
/
NO2
1.2.2 М-нитробензойная кислота
Так как м-нитробензойная кислота содержит две функциональные группы, карбоксильную – CO – OH и нитро – NO2 группы, для нее характерны реакции как для карбоновых кислот и как для нитросоединений.
1.2.2.1 Реакции идущие с карбоксильной группой
1.2.2.1.1 Образование солей
 |  |
 – COOH + NaOH – CO – ONa + H2O
– COOH + NaOH – CO – ONa + H2O
/ /
NO2 NO2
1.2.2.1.2 Восстановление



 LiAlH4
LiAlH4
 – COOH – CH2OH
– COOH – CH2OH
/ /
NO2 NO2
1.2.2.1.3 Реакция этерификации




 H +
H +
– COOH + C2H5OH – CO – OC2H5 + H2O
/ /
NO2 NO2
1.2.2.1.4 Образование хлорангидридов
Образуются действием хлорида фосфора (V) на кислоту:
 |  |
 – COOH + PCl5 – CO – Cl + POCl3 + HCl
– COOH + PCl5 – CO – Cl + POCl3 + HCl
/ /
NO2 NO2
Хлорангидрид может быть получен также действием хлористого тионила:
 |  |
 – COOH + SOCl2 – CO – Cl + SO2 + HCl
– COOH + SOCl2 – CO – Cl + SO2 + HCl
/ /
NO2 NO2
1.2.2.1.5 Образование ангидридов
 |  |  |
 2 – COOH + P2O5 – C – O – C – + 2HPO3
2 – COOH + P2O5 – C – O – C – + 2HPO3
|| ||
/ / O O \
NO2 NO2 NO2
1.2.2.1.6 Образование амидов
 |  |
 – COOH + NH3 – CO – NH2 + HCl
– COOH + NH3 – CO – NH2 + HCl
/ /
NO2 NO2
1.2.2.2 Реакции идущие с нитрогруппой
1.2.2.2.1 Восстановление



 6H +
6H +
 – COOH – COOH + 2H2O
– COOH – COOH + 2H2O
/ /
NO2 NH2
1.2.3 Бензойнокислый калий
1.2.3.1 Взаимодействие с сильными минеральными кислотами
Так как карбоновые кислоты – слабые кислоты, то сильные минеральные кислоты вытесняют их из соответствующих солей:
 |  |
 COOK + HCl – COOH + KCl
COOK + HCl – COOH + KCl
1.2.3.2 Взаимодействие с водой
Соли бензойной кислоты в водных растворах гидролизованы:
 |  |
 – COOK + H2О – COOH + KОН
– COOK + H2О – COOH + KОН
1.2.3.3 Образование ангидридов кислот
Ангидриды кислот образуютcя при нагревании смеси галогенангидрида кислоты и ее безводной соли:
 O O
O O






 // \\
// \\
 – COOK + ClCO – – C – O – C – + KCl
– COOK + ClCO – – C – O – C – + KCl
1.2.3.4 Пиролиз солей щелочных металлов
При сплавлении солей щелочных металлов бензойной кислоты со щелочами происходит расщепление углеродной цепи и декарбоксилирование, в результате чего из углеродного радикала кислоты образуется бензол:
 | |||
 | |||
 – COOK + КОН + К2СО3
– COOK + КОН + К2СО3
1.2.4 Толуол
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
1.2.4.1 Реакции в ароматическом кольце
Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.
1.2.4.1.1 Нитрование
 |  |  |
 – CH3 + HNO3 – CH3 + NO2 – – CH3
– CH3 + HNO3 – CH3 + NO2 – – CH3
\
NO2
1.2.4.1.2 Хлорирование
Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
 |  |

 AlCl3
AlCl3

 – CH3 + Cl2 – CH3 + HCl
– CH3 + Cl2 – CH3 + HCl
\
Cl
 |
Cl – – CH3 + HCl
1.2.4.1.3 Сульфирование
Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:





 – CH3 + H2SO4 – CH3
– CH3 + H2SO4 – CH3
\
SO3H
 |
SO3H – – CH3
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
1.2.4.2 Реакции в боковой цепи
Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
1.2.4.2.1 Галогенирование по радикальному механизму
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
нитробензойный кислота толуол ангидрид
 |  |
 – CH3 + Cl2 – CH2Сl + HCl
– CH3 + Cl2 – CH2Сl + HCl
Эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:





 + Cl2 + Cl2
+ Cl2 + Cl2

 – CH2Сl – CHСl 2 – CСl 3
– CH2Сl – CHСl 2 – CСl 3
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
1.2.4.2.2. Окисление
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):



 + МnO2
+ МnO2
 – CH3 – CHO
– CH3 – CHO
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:




 CHO – COOH
CHO – COOH
1.3 Механизмы реакций получения
Механизм получения м-нитробензойной кислоты
Получение м-нитробензойной кислоты из толуола происходит в две стадии: пожалой наиболее главной является реакция нитрования.
Нитрование – это реакция электрофильного замещения. Реакцию обычно проводят смесью концентрированных азотной и серной кислот. Действующим агентом нитрования является образующийся в этой смеси катион нитрония +NO2:
Рассмотрим механизм реакции нитрования бензола
 HNO3 + 2H2SO4 +NO2: + 2HSO4- + H3O
HNO3 + 2H2SO4 +NO2: + 2HSO4- + H3O
нитроний- гидроксоний- ион
катион
Далее нитроний-катион взаимодействует с ароматическим водородом, атакуя π-облако бензола, в результате чего сначала образуется π-комплекс, а затем σ-комплекс (карбониевый ион) с ковалентной связью между нитрогруппой и углеродным атомом бензольного кольца. В последней стадии ион HSO4- отрывает ион водорода и образуется продукт замещения – нитросоединение, причем т.к группа СООН является заместителем второго рода, группа NO2 ориентируется в мето-положение:
H






 + NO2 + NO2 / + НSO4-
+ NO2 + NO2 / + НSO4-



 – – NO2
– – NO2
\ – Н (быстро)
NO2
Схематично реакцию можно записать так.
 АrН + НОNO2 Аr NO2 + Н2О
АrН + НОNO2 Аr NO2 + Н2О
Присутствие в реакционной смеси воды мешает течению реакции, так как вода участвует в процессе, обратном образованию катиона нитрония. Поэтому для связывания выделяющейся в реакции воды берут избыток концентрированной серной кислоты.
2. Экспериментальная часть
2.1 Получение бензойной кислоты
 |  |
 – CH3 + 2KMnO4 – COOK + 2MnO2 + KOH + H2O
– CH3 + 2KMnO4 – COOK + 2MnO2 + KOH + H2O
 |  |
 – COOK + НCl – COOH + KCl
– COOK + НCl – COOH + KCl
Date: 2015-07-01; view: 403; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |