
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Список использованных источников. 1. Prins, H. J. Condensation of Formaldehyde with Some unsaturated compounds/ h
1. Prins, H. J. Condensation of formaldehyde with some unsaturated compounds/ H. J. Prins // Chemisch Weekblad -1919. -16. –P. 1072-1073.
2. Adams, D. R. The Prins Reaction / D. R. Adams, S. P. Bhatnagar // Synthesis. -1977.-10. –P.661-672
3. El Gharbi, R. Condensation of Substituted Styrenes with Aliphatic and Aromatic Aldehydes; An Extension of the Prins Reaction / R. El Gharbi, M. Delmas, A. Gaset // Synthesis. -1981.-Vol.5.-P.361-362
4. Braddock, D. C. The Cyclopropylmethylsilane Terminated Prins Reaction: Stereoelectronic Controlled Formation of (E)-Skipped Dienes Alcohols and a (Z)-Skipped Diene Modification / D. C. Braddock, D. M. Badine, T. Gottschalk, A. Matsuno, M. Rodriguez-Lens, //Synlett – 2003. -3 0345-0348
5. B
6. Бартон, Д.Н. «Общая органическая химия»: учеб. пособие / Д.Н. Бартон -Т.11. - 1986. - 736 с.
7. Adams, D.R. The Prins reaction / D.R. Adams, Bhatnagar C.P. //Synthesis. -1977. - V.10. - P.661-672.
8. Рахманкулов, Д.Л. Механизмы реакций ацеталей: учебник / Д.Л. Рахманкулов, С.С. Злотский, Е.А. Кантор, М.Г. Сафаров, Г. Е. Заиков, В.В. Зорин, Р.А. Караханов.- М.: Химия, 1987. ̶ 291 с.
9. Рахманкулов, Д.Л. Химия и технология 1,3-диоксациклоалканов: итоги науки и техники: учеб. пособие: Т.5. / Д.Л. Рахманкулов, Р. А. Караханов, С.С. Злотский и др. ̶ М.: ВИНИТИ, 1979. ̶ С.287.
10. Greene, T.W. Protective Groups in Organic Synthesis / T. W. Greene, P.G.M. Wuts // Wiley: New York. – 1999.
11. Kocienski, P.J. Protecting Groups /P.J. Kocienski. -3 Rd Edition. Georg Thieme Verlag.-Stuttgart. -2005.-P.668
12. Meskens, F. A. J. Methods for the preparation of acetals from alchocols or oxiranes and carbonyl compounds / F. A. J. Meskens // Synthesis. -1981. – P. 501-522.
13. Krompiec, S. Transition metal compounds and complexes as catalysts in synthesis of acetals and orthoesters: Theoretical, mechanistic and practical aspects /S. Krompiec, M. Penkala, K. Szczubialka, E.K. Kowalska, // Coordination Chemistry Reviews. – 2012. – Vol. 256 (17-18). - P. 2057 -2095
14. Besbes, N. New route of synthesis of dioxlanes and oxazolidines catalyzed by silica gel / N. Besbes, E. Srasra, M. L. Efrit // Journal de la Societe Algerienne de Chimie. -2010. – Vol. 20 (1). – P.49 -60.
15. Karame, I. Mild and efficient protection of diol and carbonyls as cyclic acetals catalysed by iron (III) chloride / I. Karame, M. Alame, A. Kanj, G.N.Baydoun, H. Hazimeh, M. El Masri, L. Christ //Comptes Rendus Chemie. -2011. – Vol. 14(6). –P. 525-529.
16. Aliyan, H. Acetalization of carbonyl compounds catalyzed by bismuth triflate under solvent- free conditions / H. Aliyan, R. Fazaeli, A.R. Massah, H.J. Naghash, B. Moeinifard // Asian Journal of Chemistry. -2010. – Vol. 22(2). – P. 873-876
17. Moghadam, M. Highly efficient and chemoselective acetalization of carbonyl compounds catalyzed by new and reusable zirconyl triflate ZrO(OTf)2 / M. Moghadam, I. Mohammadpoor- Baltork, S. Tangestaninejad, V. Mirkhani, P. Yazdani, S. Ghorjipoor // Heteroatom Chemistry. -2009. – Vol. 20(3). –P. 131 -135.
18. Камалов, Г. Д. Особо чистые вещества. Г. Д. Камалов, В. Е. Кузьмин, Л. Я. Глинская // – 1980. - № 2. – С.39.
19. Anteunis, M. Review on the Conformational Aspects in the 1,3- Dioxane System / D. Tavernier, T. A. Borremans// Heterocycles.- 1976. -Vol. 4.(2).-P. 293.
20. Danneels, D. Influence of Methyl Substituents,on the Chemical Shift of the Ring Protons in Mono-, Di- and Triemethylcyclohexanes. A 300 MHz Study of the H NMR Spectrum of Cis-l,3-dimethylcyclohexane / D. Danneels, M. Anteunis // Org. Magn. Reson. - 1974. -V.6. - P. 617-621.
21. Pat. 2 312 963 Germany, \ Hartmann L.A. // Chem. Abstr. – 1974. – V. 80 -14911 m.
22. Pat. 3 795 682 United States, Synthesis of cyclic ketals/ S.Y. Delavarenne; Union Carbide Corporation №696/ 58; Filed. 27.07.1970; Published 5.04.1974, Vol.80.-P.4.
23. Becu, Chr. Preparation of the four isomeric 2-trifluoromethy1-4dimethylaminomethyl -1, 3-dioxolan methiodides / Chr. Becu, M. Anteunis // J. Fluorine Chem. – 1975. – V. 5(5). – P. 381.
24. Gutzmann, J. Eine bequemte Synthese von 2-Aryl-2-vinyl-l,3.-dioxolanen und –dioxanen/ J. Gutzmann, P. Messinger //Arch. Pharm. -1995. - B.328. - №6. - S.523-525.
25. Kostikov, A.P. Caging Carbonyl Compounds as Photolabile (2,5- Dihydroxyphenyl) ethylene Glycol Acetals / A.P. Kostikov, N. Malashikhina, V.V. Popik // Journal of Organic Chemistry. -2009. –Vol. 74 (4). –P. 1802-1804.
26. Van Cauwenberger R., // R. Van Cauwenberger, M. Anteunis L. Valex // Bull.Soc. Chem. Belg. – 1974. – V. 82, №7. – P.285
27. Pat. 58 49 376 Japan // Chem. Abstr. – 1983. – V.99. – 53730 p.
28. Gozlan, C. Preparation of amphiphilic sorbitan monoethers through hydrogenolysis of sorbitan acetals and evaluation as bio-based surfactant / C. Gozlan, E. Deruer, M.C. Duclos, V. Molinier, J.M. Aubry, A. Redl, N. Duguet, M. Lemaire //Green Chemistry.- 2016. – Vol.18(7). - P. 1994-2004.
29. Nagy, I. Synthesis of Some Selectively N-Protected (1S,2S)-p-Nitrophenylserinol-Based Diamino-1,3-dioxanes and Tripodands / I. Nagy, O. Moldovan, F. Popa, P. Lameiras, C. Morar, C. Sacalis, M. Darabantu //Synthetic Communications. -2015. – Vol. 45(20). –P. 2319-2330.
30. Eissmann, D. Synthesis and solvent sorption characteristics of new types of tartaric acid, lactic acid and TADDOL derived receptor compounds. / D. Eissmann, F.Katzsch, E. Weber // Tetrahedron. -2015. – Vol. 71(40). – P. 7695-7705.
31. Yadav, D.B. Synthesis of Diverse 6-Oxa-allocolchicinoids by a Suzuki- Miyaura Coupling, Acid – Catalyzed Intramolecular Transacetalization Strategy / D.B. Yadav, L. Taleli, A.E. van der Westhuyen, M.A. Fernandes, M. Dragoun, A. Prokop, H.G. Schmalz, C.B. de Koning, W.A.L. van Otterlo // European Journal of Organic Chemistry. – 2015. –Vol. 2015(23). –P. 5167 -5182.
32. Hasabnis, A. Acetalization of Glycerol with Formaldehyde by Reactive Distillation/ A. Hasabnis, S. Mahajani // Industrial &Engineering Chemistry Research. - 2014. Vol. 53(31). – P. 12279 - 12287.
33. Battisti, U. Transacetalization of acetals with butane-1,2,4-triol using cobalt (II) chloride and chlorotrilmethylsilane/ U. Battisti, C. Sorbi, S. Franchini, A. Tait, L. Brasili// Synthesis. – 2014. – Vol. 46(7). – P. 943 -946,4
34. Рахманкулов Д.Л., Анищенко А. Ф., Симонов В. В.// Докл. АН СССР. 1973.- Т.208, № 1. – С. 114.
35. Рахманкулов Д.Л., Злотский С. С., Анищенко А.Ф.// ЖОрХ. – 1972.- Т.8, №8. – С. 1765.
36. Рахманкулов Д.Л., Злотский С. С., Симонов В.В. // ЖОрХ. – 1973.- Т.9, №7. – С. 1544.
37. А. с. 427934 СССР/ Рахманкулов Д. Л. // Б. И. – 1974. - № 57.
38. Сапрыгина, В.А. Синтезы циклических ацеталей на, основе 2-дигалоидметил-1,3-диоксоланов / В.А. Сапрыгина, С.С. Злотский, Д.Л. Рахманкулов // Журнал прикладной химии.- 1996. - Т.69.- №. 3. - С. 515.
39. Злотский, С.С. Активность 1,3-диоксациклоалканов в реакциях с дигалогенкарбенами / С.С. Злотский, В.А. Сапрыгина, Д.Л. Рахманкулов // Журнал общей химии.- 1995.-Т.67.- №. 4.- С.681.
40. Сапрыгина, В. А. Взаимодействие 2-(2-этил) -винил-1,3-диоксолана с ди-галогенкарбенами / В. А. Сапрыгина, С.С. Злотский, Д.Л. Рахманкулов, М. Дан // Баш.хим.ж. - 1995. – Т. 2.- № 3-4. – С. 20.
41. Lytko- Krasuska, A. Reductive elimination of a tertiary nitro group in 5-nitro-1,3-dioxanes / A. Lytko- Krasuska, H. Piotrovska, T. Urbanski // Tetrahedron Letters.-Vol. 20 (14).- 1979. P. 1243-1246
42. Зорин, В.В. Превращение 5-бром-5-нитпо-1,3-диоксанов под действием этил-меркалтида натрия / В.В. Зорин, Д.М. Куковицкий, С.С. Злотский, З.В. Тодрес, Д.Л. Рахманкулов // ЖОрХ. – 1983. –Т.53. - №4. – С. 906-910.
43. Куковицкий Д.М., Зорин В.В., Злотский С.С., Тодрес З.В., Рахманкулов Д.Л. // ХГС. – 1982. – С. 846.
44. Куковицкий Д.М., Злотский С.С., Зелечонок Ю.Б., Зорин В.В.// Химия и технология ацеталей и их гетероаналогов: Тез. Докл. –Уфа, 1981. – С.102.
45. Зорин, В.В. Превращения 5-бром-5-нитро-1,3-диоксанов под действием этилмеркаптида натрия / В.В. Зорин, Д.М. Куковицкий, С.С. Злотский, З.В. Тодрес, Д.Л. Рахманкулов // ЖОрХ. – 1983.- Т.53(115). – С. 906-910.
46. Kornblum, N. Substitution Reactions Which Proceed via Radical Anion Intermediates/ N. Kornblum // Angew. Chem. – 1975. - № 87. – С.897.
47. Зорин В.В., Куковицкий Д.М., Злотский С.С., Тодрес З.В., Рахманкулов Д.Л. // ЖОрХ. – 1984. – Т.20, № 4.- С. 864.
48. Зорин В.В., Куковицкий Д.М., Злотский С.С., Тодрес З.В., Рахманкулов Д.Л. // ЖОХ. – 1984. – Т.54, № 4.- С. 828.
49. Зорин, В.В. Взаимодействие цис- и транс-2-метил-5-бром-1,3-диоксанов с литиевой солью 2-метил-5-нитро-1,3-диоксана / В.В. Зорин, Д.М. Куковицкий, Л.Ф. Лапука, С.С. Злотский, З.В. Тодрес, Д.Л. Рахманкулов // ЖОрХ. – 1983. – Т.19.- № 8.- С. 1753.
50. Зорин, В.В. Синтез и строение некоторых 5-(5-нитро-2-Я-1,3-диокса-5-циклогексил)-2-К-1,3- диоксанов / В.В. Зорин, Д.М. Куковицкий, Л.Ф. Лапука, В.Н. Трифонова, Д.Л. Рахманкулов // ЖОрХ. – 1995. – Т.30, вып.2. - С. 445-456.
51. Дашкина, Л.Р. Катализируемое палладием аллилрование солей незамещенного и замещенных 5-нитро-1,3-диоксанов / Л.Р. Дашкина, А.П. Кулак, А.Н.Касаткин, P.P. Муслухов, В.В. Зорин, Д.Л. Рахманкулов, И.П. Белецкая // ЖОрХ. -1994.-Т.30.-Вып.11.-С.1656-1659.
52. Зорин, В.В. Превращения 5-бром-5-нитро-1,3-диоксанов под действием этилмеркаптида натрия./ В.В. Зорин, Д.М. Куковицкий, С.С. Злотский, З.В. Тодрес, Д.Л. Рахманкулов // ЖОрХ.-1983. – Т.53, № 4.- С. 906.
53. Зорин, В.В. / В.В. Зорин, Д.М. Куковицкий, С.С. Злотский, З.В. Тодрес, Д.Л. Рахманкулов // ЖОрХ. – 1985. – Т.21.- № 2.- С. 463.
54. http://www/crc.dk/nmr/nmrcenter/index.shtml
55. Гюнтер, Х. Введение в курс спектроскопии ЯМР: учебное пособие / Х. Гюнтер. М.: Мир, 1984.- 480с
56. Эмсли, Дж. Спектроскопия высокого разрешения: 2-х т. монография / Дж. Эмсли, Дж. Финей, Л. Сатклиф т.1, т.2. М.: Мир, 1968-1969. -630 с.
57. Ионин, Б.И. ЯМР спектроскопия в органической химии: учебное пособие / Б.И. Ионин, Б. А. Ершов. - 2 -е изд., - Л.: Химия, 1983.-272с.
58. Жунке, А. Ядерный магнитный резонанс в органической химии: справочное и учебное пособие для химиков-органиков / А. Жунке. М.: Мир, 1974.-178с.
59. Тимоти, Д.В. Современные методики ЯМР высокого разрешения в химии: учебник/ Д.В. Тимоти, Т.М. Кларидж. – Перев. с англ..- Турова А.В, Пенского Д.А., К.: -2006. -350с
60. Сликтер, Ч. Основы теории магнитного резонанса: учебник / Ч. Сликтер. -2-е изд., переработанное и дополненное. - М.: Мир, 1981.-448с.
61. Волоненко, Ю.М. Спектроскопия ядерного магнитного резонанса для химиков: учебник / Ю.М. Волоненко, В.Г. Карцев, И.В. Комаров. – М.:Мир, 2011.- 704с.: ил — ISBN 978-5-903078-34-9
62. Дероум, Э. Современные методы ЯМР для химических исследований: монография/ Э. Дероум. -М.: Мир, 1992.- 403с.
63. Зефиров, Н.С. Аномерныйэффект /Н.С. Зефиров, Н.М. Шехтман // Успехи химии. -1971. – T.2. - № 4. - C. 593.
64. А.А. Богомазова, Современная химия циклических ацеталей Н.Н. Михайлова, С.С. Злотский, Saarbrucken, Germany: LAP LAMBERT Academic Publishing, 2012, 87.
65. Yong, X. Synthesis of difluoromethyl substituted lysophosphatidic acid analogues / X. Yong, Q. Lian, A.V. Pontsler, T.M. McIntyre, G.D. Prestwich // Tetrahedron.- 2004.- Vol.60(1).-C. 43.
66. Silva Paulo, H.R. Glycerol acetals as anti-freezing additives for biodiesel / H.R. Silva Paulo, L.C. Goncalves Valter, J.A. Mota Claudio //Bioresource Technology.- 2010.- Vol.101(15). –C. 6225–6229.
67. Karinen, R.S. New Biocomponents from Glycerol / R.S. Karinen, A.O.I. Krause // Appl. Catal. A. – 2006. – V 306. –P. 128.
68. Cho, G.H.P. Glycerol esters from the reaction of glycerol with dicarboxylic acid esters /G.H.P. Cho, T.L. Ooi, S.K. Yeong, C.H. Chuah// J. Surfactants Detterg. – 2006.-Vol. 9. -C.147.
69. Goncalves, V.L.C. Acetylation of glycerol catalyzed by different solid acids / V.L.C. Goncalves, B.P. Pinto, J.C. da Silva, C.J.A. Mota, //Catal. Today.-2008-Vol.133.-C. 673.
70. Climent, M.J. Synthesis of hyacinth, vanilla, and blossom orange fragrances: the benefit of using zeolites and delaminated zeolites as catalysts / M.J. Climent, A. Corma, A. Veltry// Appl. Catal. A.- 2004.-Vol.155. –C.161.
71. Раскильдина, Г.З. Получение, строение и превращения циклических формалей глицирина/ Г.З. Раскильдина, В.Ф. Валиев, Р.М. Султанова, С.С. Злотский// Журн.прикл.химии.-2015,- 88 (5).- C. 621 [G.Z. Raskil'dina, V.F. Valiev, R.M. Sultanova, S.S. Zlotskij, J. Appl. Chem. USSR; с 1992 г. – Russ. J. Appl. Chem. (Engl. Transl.).- 2015.-Vol.88. (5).-P. 621].
72. A. Piasecki, An Efficient Method for the Preparation of Pure Long-Chain CIS-and Trans-2-n-Alkyl-5Hydroxy-1,3-Dioxanens / A. Piasecki, B. Burczyk, A. Sokolowski, U. Kotlewska // Synth. Сommun. – 1996. – Vol.26 (22).- P. 4145.
73. Wedmid, Y. Synthesis of Cyclic Glycerol Acetal Phosphates: Proton and Carbon-13 NMR Characteristics of Isomeric 1, 3-Dioxolane and 1,3-Dioxane Phosphate Structures / Y. Wedmid, C. A. Evans, W. J. Baumann //Org. Chem.-1980. - Vol. 45.-P.1582.
Приложения
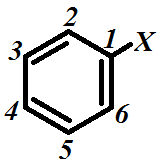
Приложение 1. Инкременты заместителей для расчета Х.С. атомов протонов в замещенных бензола [13].
| ЗаместительХ | Z2 | Z3 | Z4 |
| H | 0.00 | 0.00 | 0.00 |
| CH3 | -0.20 | -0.12 | -0.22 |
| CH2CH3 | -0.14 | -0.06 | -0.17 |
| C(CH3)3 | -0.02 | -0.08 | -0.21 |
| CH2Cl | 0.00 | 0.00 | 0.00 |
| CF3 | 0.32 | 0.14 | 0.20 |
| CCl3 | 0.64 | 0.13 | 0.10 |
| CH2OH | -0.07 | -0.07 | -0.07 |
| CH=CH2 | 0.06 | -0.03 | -0.10 |
| Ph | 0.37 | 0.20 | 0.10 |
| F | 0.26 | 0.00 | -0.20 |
| Cl | 0.03 | -0.02 | -0.09 |
| Br | 0.18 | -0.08 | -0.04 |
| I | 0.39 | -0.21 | 0.00 |
| OCH3 | -0.48 | -0.09 | -0.44 |
| OH | -0.56 | -0.12 | -0.45 |
| NO2 | 0.95 | 0.26 | 0.38 |
| COCH3 | 0.62 | 0.13 | 0.20 |
| NH2 | -0.75 | -0.25 | -0.65 |
Приложение 2. Спектр ЯМР 1Н смеси спиртов смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 3. Спектр ЯМР1Н соединения смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 4. Обычный углеродный спектр и DEPT-отредактированные спектры соединении смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 5. Спектр HSQC соеденении смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 6. Спектр НМВС соединении смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 7. Спектр COSY соединении смеси 4-гидроксиметил-1,3-диоксолана 1а и 5-гидрокси-1,3-диоксана 1б
Приложение 8. Спектр ПМР соединения 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
Приложение 9. Обычный углеродный спектр и DEPT-отредактированные спектры соединении 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
Приложение 10. Фрагмент спектра 13С соединении 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
Приложение 11. Спектр HSQC и фрагмент Спектра HSQC соеденении 4-[(бензилокси)метил]-1,3-диоксолана 2а и 5-(бензилокси)-1,3-диоксана 2б
а) б)
Приложение 12. Спектр НМВС соединении 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
Приложение 13. спектр COSY соединении4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
фрагмент спектра COSY соединении 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
а) б)
Приложение 14. Спектр NOESY и фрагмент спектра соединении 4-[(бензилокси)метил]-1,3-диоксолана и 5-(бензилокси)-1,3-диоксана
а) б)
Date: 2016-05-23; view: 581; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |