
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа № 10
Тема. Определение железа(III) с сульфосалициловой кислотой
Цель работы. Изучить принцип фотометрического метода анализа. Определить содержание железа(III) с сульфосалициловой кислотой фотометрическим методом.
Приборы, реактивы, посуда. Колориметр концентрационный; кюветы на 50 мм; пипетки мерные вместимостью 2, 5, 10 см3; колбы мерные вместимостью 50 см3, конические колбы вместимостью 50 см3; пробирки; вода дистиллированная; кислота серная, растворы с концентрацией 1 М и с массовой долей ω = 16%; кислота сульфосалициловая, раствор с ω = 10%; квасцы железоаммонийные, х.ч. или ч.д.а.
Стандартный раствор железа(III), содержащий 1 мг/мл (раствор А), готовят следующим образом: 8,6350 г железоаммонийных квасцов растворяют в воде, содержащей 25 мл раствора серной кислоты с массовой долей ω = 16% и доводят объем раствора водой до метки в мерной колбе вместимостью 1 л. Содержание Fе(III) в приготовленном растворе составляет 1,000±0,005 мг/мл. Разбавителем основного раствора является раствор серной кислоты с концентрацией С(1/2 H2SO4 ) = 0,01 моль/л (0,01 н).
Раствор, содержащий 0,1 мг/мл, готовят следующим образом: в мерную колбу вместимостью 100 мл помещают 10 мл раствора А и доводят до метки 0,01 н раствором серной кислоты, перемешивают.
Принцип метода. Фотометрические методы анализа основаны на зависимости между интенсивностью окраски раствора и концентрацией вещества. Зависимость величины аналитического сигнала от концентрации выражается уравнением основного закона светопоглощения (закон Бугера-Ламберта-Бера):
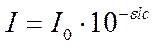 ,
,
или 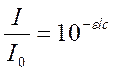 ,
,
или A = εlc,
где А - оптическая плотность раствора;
I0 - интенсивность падающего потока;
I - интенсивность прошедшего потока света через поглощающий раствор;
l - толщина поглощающего слоя, см;
С - концентрация поглощающего вещества, моль/л;
ελ - молярный коэффициент поглощения.
Если принять l = 1см і с = 1 моль/л, тогда А = ε. Таким образом, молярный коэффициент поглощения рамен оптической плотности одномолярного раствора при толщине поглощающего слоя 1 см и характеризует чувствительность определения.
Date: 2015-05-17; view: 1743; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |