
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамические состояния и термодинамические процессы
Равновесным называется такое состояние термодинамической системы, в котором отсутствуют потоки энергии, вещества, импульса, а макроскопические параметры системы являются установившимися и не меняются во времени.
Нулевое начало термодинамики: изолированная система стремится к состоянию термодинамического равновесия и после его достижения не может самопроизвольно из него выйти.
Равновесные состояния обладают следующими свойствами:
1) если две термодинамические системы, имеющие тепловой контакт, находятся в состоянии термодинамического равновесия, то и общая система, состоящая из этих двух, находится в состоянии термодинамического равновесия;
2) если какая-либо термодинамическая система находится в термодинамическом равновесии с двумя другими системами, то и эти две системы находятся в термодинамическом равновесии друг с другом.
Величиной, характеризующей состояние термодинамического равновесия макросистемы, является температура. Если при установлении теплового контакта между телами одно из тел передаёт энергию другому посредством теплопередачи, то считают, что первое тело имеет большую температуру, чем второе.
Состояние макросистемы характеризуют величинами, которые называют термодинамическими параметрами (давление р, объём V, температура Т, концентрация п и др.).
Равновесное состояние можно представить точкой в пространстве, по координатным осям которого откладываются значения параметров состояния.
Переход из одного термодинамического состояния в другое называется термодинамическим процессом.
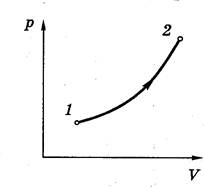 Равновесным или квазистатическим процессом называют процесс, проходящий достаточно медленно и состоящий из непрерывно следующих одно за другим состояний термодинамического равновесия. Он может быть изображён, например, на диаграмме p,V соответствующей кривой.
Равновесным или квазистатическим процессом называют процесс, проходящий достаточно медленно и состоящий из непрерывно следующих одно за другим состояний термодинамического равновесия. Он может быть изображён, например, на диаграмме p,V соответствующей кривой.
Неравновесные процессы условно изображают пунктирными кривыми.
Равновесный процесс может быть проведён в обратном направлении через ту же совокупность равновесных состояний, т.е. по той же кривой  , но в обратном направлении
, но в обратном направлении  . По этой причине равновесные процессы называют обратимыми.
. По этой причине равновесные процессы называют обратимыми.
Круговым или циклическим называют процесс, в ходе которого система возвращается в исходное состояние. Круговые термодинамические процессы могут быть как равновесными (обратимыми) так и неравновесными (необратимыми). При равновесном круговом процессе, после возвращения системы в исходное состояние, в окружающих её телах не возникает никаких термодинамических возмущений и их состояния остаются равновесными (внешние параметры системы после осуществления циклического процесса возвращаются к своим исходным состояниям)
Внутренняя энергия термодинамической системы.
Внутренней энергией U макросистемы называют величину, состоящую из:
1) суммарной кинетической энергии хаотического движения молекул в Ц-системе, связанной с самой системой, в которой суммарный импульс всех молекул равен нулю;
2) собственной потенциальной энергии взаимодействия всех молекул, т.е. энергии взаимодействия только между молекулами, принадлежащими данной системе;
3) внутренней энергии самих молекул, атомов и ядер.
В термодинамике внутреннюю энергию определяют с точностью до некоторой постоянной. Определяющим в термодинамике является изменение внутренней энергии системы Δ U.
Наиболее существенное отличие внутренней энергии U в том, что она является функцией состояния и не зависит от того, каким путём система приведена в данное состояние. Изменение внутренней энергии определяется только конечным и начальным состояниями и не зависит от процесса, который перевёл систему из одного состояния в другое.
Если макросистема состоит из нескольких частей, то внутренняя энергия всей системы равна практически сумме внутренних энергий её частей.
Date: 2015-05-09; view: 1051; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |