
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

В термодинамике. Внутренняя энергия
В механике работа, совершаемая над телом внешней силой F, находится интегрированием вдоль траектории движения элементарной работы, которая равна скалярному произведению вектора силы на вектор элементарного перемещения тела dl:
dA = (F·dl). (2.1)
Понятие работы было введено для измерения количества энергии, передаваемой силовым, то есть механическим способом (чтобы отличать его от немеханического, теплового способа передачи энергии), и под работой всегда подразумевается макроскопическая работа на макроскопически наблюдаемом пути.
Следует еще раз подчеркнуть, что хотя через работу и измеряется количество переданной энергии, но между работой и энергией имеется существенное различие, поскольку работа является функцией процесса, то есть зависит от соотношения в этом процессе разных способов передачи энергии. А энергия системы является функцией состояния системы, то есть функцией координат и импульсов составляющих ее частиц. При переходе системы из одного состояния в другое системой совершается разная работа при разных путях (траекториях) перехода, хотя изменение энергии системы будет одно и то же, то есть не существует закона сохранения работы в отличие от закона сохранения энергии. Хотя с точки зрения сохранения механической энергии это выглядит непонятным, но если учесть возможность передачи энергии без совершения макроскопической работы, но через микропроцессы, то есть тепловым способом (который не учитывается в механике), то все становится на свои места. В термодинамике можно изменять состояние системы, совершая над системой работу, связанную с макроскопическими перемещениями, но можно изменять и сообщая системе некоторое количество теплоты, то есть совершая суммарную микроскопическую работу по изменению энергии микрочастиц, не связанную прямо с макроскопически наблюдаемыми перемещениями частей системы.
Теплота аналогична работе в том смысле, что она также является функцией процесса передачи энергии, а не функцией начального и конечного состояний системы. С точки зрения математики различие функций состояния и функций процесса проявляется в том, что элементарное изменение энергии термодинамической системы является полным дифференциалом (таким дифференциальным количеством, интеграл от которого по замкнутой траектории дает ноль), что справедливо для всех функций состояния. В то же время элементарная работа и элементарное количество теплоты в общем случае полными дифференциалами не являются, что часто фиксируется посредством специальной символики, чем мы тоже воспользуемся.
Теперь мы можем написать в обобщенной форме закон сохранения энергии, который в термодинамике называется ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
dQ = dU + dА (2.2)
Это уравнение имеет прозрачный смысл и означает, что разность между полученной термодинамической системой теплотой (энергией, переданной системе тепловым способом) и работой системы (энергией, отданной системой окружению силовым способом) характеризует изменение энергетического состояния системы. Это энергетическое состояние системы описывается функцией, называемой внутренней энергией, которая (в отличие, как от теплоты, так и от работы) не зависит от способа перехода системы в данное состояние, то есть является функцией состояния.
Можно сказать и по другому: переданная системе теплота может быть потрачена как на изменение внутренней энергии системы (то есть суммарной кинетической и потенциальной энергии микрочастиц, не связанной с макроскопическим движением системы, как целого, и с взаимодействием с внешними телами), так и на совершение системой макроскопической работы против внешних сил. В адиабатном (без теплообмена с внешними телами) процессе dQ = 0 и тогда dА = – dU, и смысл внутренней энергии U становится очевиден – это внутренняя энергетическая характеристика системы. В условиях теплоизоляции работа покоящейся как целое системы может совершаться только за счет внутренних энергетических ресурсов.
Иногда первое начало рассматривают как определение внутренней энергии, поскольку энергия покоящейся как целое системы может быть изменена двумя способами – совершением над системой работы или передачей системе теплоты. Поскольку в термодинамике обычно не интересуются движением системы как целого, и она просто предполагается покоящейся, то поступающая в систему энергия в любой форме должна вызвать изменение внутренней энергетической характеристики, которая и называется внутренней энергией.
Из уравнения (2.2) видно, что в теплоизолированной системе работа не зависит от пути перехода из начального состояния в конечное, так как в противном случае нарушится закон сохранения энергии. Действительно, если начальное и конечное состояние одно и то же, то работа должна равняться нулю, иначе это будет вечный двигатель (первого рода). Следовательно, внутренняя энергия есть функция состояния.
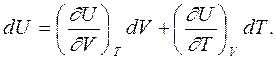 |
Для всякой функции состояния ее дифференциал может быть выражен через сумму частных производных, поэтому для внутренней энергии (считая ее функцией объема и температуры) ее дифференциал можно записать в следующем, часто используемом виде
Открытый Робертом Майером (1842) общефизический закон сохранения энергии (2.2) утверждает эквивалентность передачи энергии силовым и тепловым способами, что, естественно, сразу породило стремление свести тепловые процессы к механическим (пусть на микроскопическом уровне). Таким образом, открытие общефизического закона сохранения энергии дало мощный толчок к развитию молекулярно-кинетической теории, и вскоре начала формироваться, наряду с феноменологической термодинамикой, механическая теория теплоты – статистическая механика.
Из уравнения (2.2) следует, что если термодинамическая система совершает циклический процесс (с поступлением в систему теплоты и совершением работы), в результате которого система возвращается в первоначальное состояние (то есть в состояние с той же самой внутренней энергией), то вся полученная системой теплота DQ может быть (по крайней мере, теоретически) преобразована в работу DA, то есть DQ = DA, поскольку DU = 0. Таким образом, первое начало термодинамики, как общефизический закон сохранения энергии, не накладывает никаких ограничений на преобразование энергии хаотического движения микрочастиц в механическую энергию упорядоченных движений макроскопических тел. Это как раз то, что выполняют в технике тепловые машины. Коэффициент полезного действия этих машин h (отношение полной работы A, совершенной машиной за цикл, к полученной машиной за цикл теплоте Q) как будто может быть равным 100%, то есть h = A/Q =1. Однако все оказалось сложнее.
Для дальнейшего рассмотрения вопросов преобразования энергии нам надо рассмотреть влияние условий передачи теплоты, так как количество передаваемой теплоты, как уже отмечалось, является функцией процесса передачи. Для этого, прежде всего, необходимо, опираясь на понятия теплоты и температуры, ввести понятие теплоемкости.
Date: 2015-05-09; view: 684; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |