
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Опыт 3. Коррозия луженого и оцинкованного железа с нарушенным покрытием
Наиболее распространенным способом защиты металлических изделий и сооружений от электрохимической коррозии являются металлические покрытия. Их роль сводится к изоляции поверхности металла от коррозионной среды. В зависимости от характера процессов, протекающих в коррозийной зоне при их повреждении, металлические покрытия делят на анодные и катодные. Анодными называют металлические покрытия, у которых электродный потенциал более отрицателен, чем электродный потенциал защищаемого металла (например оцинкованное железо, рис. 8.2А). К катодным относят покрытия с более положительным значением электродного потенциала, чем потенциал защищаемого металла (например луженое железо, рис. 8.2Б).
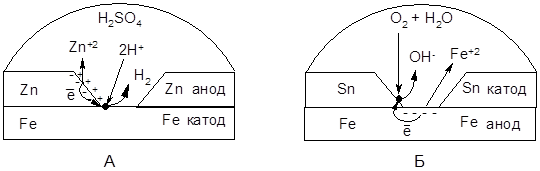 |
Рисунок 8.2 – Схема коррозии с нарушенным металлическим покрытием: А – оцинкованное железо (покрытие из цинка) в кислой среде; Б – луженое железо (покрытие из олова) в нейтральной среде.
Реактивы: 2 Н раствор серной кислоты, 3 %-ный раствор красной кровяной соли К3[Fe(CN)6], кусочки оцинкованного и луженого железа с нарушенным покрытием.
Посуда: две широкие пробирки.
Методика проведения опыта: Налейте в две пробирки по 2-3 см3 серной кислоты и добавьте в них по 2-3 капли раствора красной кровяной соли. В одну пробирку опустите два кусочка оцинкованного железа, а в другую – луженого железа. Наблюдайте, в какой из пробирок через некоторое время появляется синее окрашивание и объясните почему. Отразите это в лабораторном журнале и напишите уравнение реакции получения турнбулевой сини (с. 13, лаб. раб. 7.2, опыт 1).
Составьте схемы коррозии оцинкованного и луженого железа в кислой среде, схему образовавшегося микрогальванического элемента; напишите электронные уравнения анодного и катодного процессов.
В выводах отразите:
– в каком из проведенных опытов коррозия протекала при нарушении анодного покрытия, а в каком случае – при нарушении катодного; объясните, как определяется тип покрытия (анодный или катодный);
– где и с какой целью используют эти покрытия.
Опыт 5 Изучение влияния природы ингибитора на скорость коррозии (УИРС)
Ингибиторами коррозии называют вещества, которые при введении их в окружающую среду или при нанесении на поверхность металла значительно снижают скорость коррозии. Ингибиторы применяют главным образом в системах с постоянным объемом раствора. По механизму своего действия на процесс электрохимической коррозии ингибиторы подразделяют на катодные и анодные.
Катодные ингибиторы, адсорбируясь на поверхности катода, уменьшают площадь его контакта с деполяризаторами, тем самым снижают интенсивность катодного процесса. Катодными ингибиторами чаще всего бывают органические вещества: альдегиды, аминокислоты, мочевина, тиомочевина и др. Анодные ингибиторы (нитриты, дихроматы, фосфаты, силикаты и др.), иначе называемые пассиваторами, образуют защитную пленку на анодных поверхностях металла и, как правило, обладают окислительными свойствами. Защитным действием обладают также оксидные, солевые и др. пленки, образующиеся на поверхности металла при его взаимодействии с окислителями из окружающей среды, которые при определенных условиях пассивируют металл и уменьшают скорость его коррозионного разрушения.
Реактивы: дистиллированная вода, 0,1 М раствор серной кислоты H2SO4; кристаллические вещества: хлорид натрия NaCl, силикат натрия Na2SiO3, мочевина NH2CONH2, сукцинат натрия NaOOC-CH2-CH2-COONa (динатриевая соль янтарной кислоты); 3 %-ный раствор красной кровяной соли К3[Fe(CN)6]; железные пластины (скрепки, гвозди).
Посуда и принадлежности: четыре глазные пипетки, стеклянные лопаточки.
Методика проведения опыта: Налейте в четыре пробирки по 2 см3 воды. В первую пробирку добавьте одну лопаточку хлорида или силиката натрия, во вторую – 2 см3 серной кислоты, в третью – одну лопаточку мочевины, в четвертую – одну лопаточку сукцината натрия. В каждую пробирку прибавьте по 2 капли реактива на ионы железа (II) – раствор красной кровяной соли К3(Fe(CN)6). Содержимое пробирок взболтайте и в каждую опустите по железной скрепке (гвоздю). Наблюдайте за интенсивностью посинения (через какой период времени оно появится) у поверхности скрепки (гвоздя) и выделением пузырьков газа в пробирках.
Результаты опыта занесите в таблицу 8.4.
Таблица 8.4 – Результаты влияния различных ингибиторов на коррозию железа
| Номер пробирки | Добавленное изучаемое вещество | Интенсивность посинения | Интенсивность выделения пузырьков газа | Время появления посинения и пузырьков газа, мин |
| Хлорид натрия Серная кислота Мочевина Сукцинат натрия |
Приведите уравнение катодного и анодного процессов в системах с каждым из исследованных ингибиторов.
Сделайте вывод: какие из изученных веществ выполняют роль катодного, а какие – анодного ингибитора, и как влияет природа веществ на скорость коррозии.
Date: 2015-05-08; view: 6908; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |