
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коллоидты ерітінділердің тұрақтылығы
4.5.1. Коллоидты жүйелердің тұрақтылық түрлері. Коллоидты ерітінділердің тұрақтылығына олардын өз дисперстілігін, құрылымын, күйін уақыт бойынша өзгертпей бірқалыпты сақтауы жатады.
Кәдімгі ерітінділерге қарағанда коллоидты ерітінділердегі еріген бөлшектер ірілеу болып келетіндігі белгілі. Ендеше, бұлардың ауырлық күші әсерінен тұнбаға шөкпеуіне нендей күш себепші болып отыр.
Міне, бұл сұраққа, ғалым Н.П.Песков (1920), мынандай түсініктемелер жасады. Коллоидты ерітінділердің тұрақтылығына басты иететін екі күш бар. Олардың бірі еріген бөлшектердің ерітінді бойында бағыт-бағдарсыз броундық қозғалысы. Бұл кинетикалық немесе седиментациялық тұрақтық деп аталады.
Екіншісі - коллоидты бөлшектердің өз құрылымы, дисперстілігін өзгертпей сақтауы. Бұл құрылымдық немесе агрегативті тұрақтылық деп аталады.
Агрегативті тұрақтылыққа ие коллоидты ерітінділерді термодинамикалық тұрақты және термодинамикалық тұрғыда тұрақсыз деп екі түрге бөледі.
Термодинамикалық тұрақты коллоидты ерітінділер лиофильді зольдер деп аталынып, олардың коллоидты бөлшектері еріткіш бойына сырттан күш жүмсамай-ақ көшеді. Мысалы, шайырлар, майлар және т.б. заттар.
Аталған зольдер түзілу барысында Гиббс энергиясының өзгеріс шамасы теріс мәнге ие, яғни ∆G < 0. Сондықтан, мұндай жүйелерді термодинамикалық тұрақты лиофильді зольдер қатарына жатқызады. Ал біз, сырттан күш жұмсап, өзіміз ұнтақтап немесе ірілендіріп алатын коллоидты жүйелерімізде ∆G < 0 болғандықтан, олар термодинамика-лық тұрғыда тұрақсыз лиофобты зольдер тобына жатқызылады. Соңғы аталған жүйелерге өз күйін сақтап қалатындай тұрақтылық беру үшін, түрлі іс-шаралар жүзеге асырылады. Коллоидты ерітінділердегі бөлшектер өз құрылымын сақтап, агрегативті тұрақтылыққа ие болу үшін мына факторларға баса назар аударылады.
1.Термодинамикалық факторлар:
1.1.коллоидты бөлшектің бетінде электр зарядының болуы;
1.2.коллоидты бөлшектердің адсорбциялық - сольваттық қабатпен қапталуы;
1.3.бөлшектердің ретсіз броундық қозғалысқа ұмтылуы- энтропиялық фактор.
2.Кинетикалық факторлар:
2.1.жүйе тұтқырлығын өзгерту арқылы дисперсті фаза және дисперсионды орта тығыздығын реттейтін гидродинамикалық әсерді ескеру;
2.2.коллоидты бөлшек бетіне арнайы беттік белсенділікке ие (поверхностно активные) зат молекулалары арқылы серпімділікке және механикалық беріктілікке ие қорғауыш қабаттар түзілуін ескеру.
Бір қарағанда 1.2 және 2.2 әсерлері ұқсас көрінуі мүмкін.
Агрегативті тұрақтылық беретін 1.2 - әсер коллоидты бөлшекке адсорбцияланған иондардың еріткіш молекулаларымен сольваттануы арқылы түзілетін қабат. Ал 2.2 түрдегі әсер - сырттан коллоидты жүйеге қосымша қосылатын беттік белсенділікке ие заттар, яғни стабилизаторлар қосу арқылы қорғауыш қабатының түзілуі.
Мысалы, кремний диоксидінің золін тұрақтандыру үшін желатина ерітіндісін қосады. Коллоидты бөлшектер беті соңғы зат түзетін қабықшамен қапталады. Бұл қабықшалар қалыңдығы 1 нм, яғни мономолекулалық қалыңдыққа сәйкес келеді. Осындай түрдегі қабықшалар коллоидты бөлшектердің бір-біріне қосылып кетпеуіне себепші болады.
Р.Зигмонд деген ғалым осы заттардың коллоидты бөлшектерді қабықша түзіп қорғауын санды тұрғыда сипаттау үшін "алтын саны" деген көрсеткіш енгізді.
Алтын ұнтағынан түзілген коллоидты ерітіндінің түсі қызғылт болып келеді. Коллоидты жүйеде аздаған өзгеріс болса әлгі золь лезде ауа көк түске боялады, яғни өте сезімтал.
Міне осындай қорғауыш қабат түзетін қасиетке ие заттардың зольдерді қорғау қабілетін анықтауға алтын ұнтағынан түзілген золь пайдаланылады.
Алтынның қызыл түсті 10 мл золіне 1 мл 10% ас тұзы ерітіндісін құйғанда, "оны ұйытпай, яғни ауа көк түске өткізбей қорғап тұратын, қорғауыш қабат (пленка) түзетін заттың ең аз шамасы (мг) сол заттың алтын саны деп аталады.
Алтын санының шамасы неғұрлым аз болған сайын, ол зат соғұрлым жақсы қорғауыш қабілетке ие екендігін көрсетеді. Аталған заттар қатарына крахмал, гемоглобин, желатина сияқты көптеген дүниеліктер жатады.
Мысалы, желатинаның алтын саны 0,01 мг -ға тең болса, крахмал үшін бұл көрсеткіш 20-ға теңеледі.
Коллоидты ерітінділердің өз тұрақтылығын сақтауында қорғауыш заттардың алар орыны ерекше. Мысалы, адам бойындағы қан құрамында нашар еритін кальций фосфаты, карбонаты коллоидты бөлшектер түрінде ұшырасады. Осы сияқты бөлшектердің сырты белоктық немесе осы тұрғыдағы заттармен қапталып келеді. Кейбір науқасқа шалдыққан кезде адам қанының құрамында қорғауыш қабықша түзетін заттар азаяды да, әлгідей тұздар өзара бірігіп тұнбаға шөгеді. Осының салдарынаң буын-буында, бүйректе, бауырда тас тәріздес шөгінділер пайда болады. Көп жағдайларда қолданыс табатын-колларгон, протаргол-сияқты дәрі-дәрмектердің қорғауыш қабат түзетін қасиеттері бар.
Сонымен, коллоидты ерітінділердің өз күйін сол қалпында сақтауын сипаттайтын көрсеткіштер қатарына олардың кинетикалық және агрегативті немесе құрылымдық тұрақтылықтары жатады.
Аталған көрсеткіштердің, өзара, кейде бір-біріне қарсы әсері барын да ескерген жөн.
Мысалы, кез-келген сұйыққа жылу түрінде энергия берілсе, ол осы жүйе бөлшектерінің қозғалысын арттырады, яғни температурасын жоғарылатады. Қозғалыс артуы нәтижесінде бөлшектердің өзара соқтығысуы жиілейді. Өзара соқтығысқан бөлшектер қосылып,.іріленуі ықтимал, Соңғы жағдай бөлшектердің құрылымы өзгергенін, яғни аг-регативті тұрақтылықтың төмендегеніне сәйкес келеді. Іріленген бөлшектер ауырлық күшінің әсерінен ыдыс түбіне шөге бастайды.
Көптеген коллоидты ерітінділердің қыздыру барысында. Лайқаланып тұрақсыз күйге көшетіндігін жиі ұшырастыруға болады.
4.5.2. Коллоидты ерітінділердің кинетикалық тұрақтылығы. Электрокинетикалық құбылыстардың элементар теориясы. Экспериментальді берілгені бойынша электрокинетикалық потенциалды анықтайтын теңдеулерді Г. Гельмгольц бастамасымен М. Смолуховский және Ж. Перрен ашты.
Электрофорез және электроосмос теңдеулерін қорыта келе екі модельді қарастырамыз. Олардың бірі – цилиндірлік капиллярлы порлармен өткізілген жай мембрана, екіншісі – дисперсті жүйе, яғни осьтері электрлік аймақтағы тоқ сызықтарының бағытымен сәйкес келетін ұзын цилиндрлік бөлшектерден тұрады. Екі еселенген электрлік қабатты жайпақ конденсатор ретінде қараймыз. Алынғанкөлемдік қатынасты қолданған кезде орындалатын шарттар: а) капилляр немесе дисперсті фаза бөлшектерінің көлемі қосарланған элетр қабатының қалыңдығын жоғарылатады; б) сұйық молекулалары беткі бөлікке түсіп жылжып кетпейтіндей етіп жасалады; в) жүйедегі иондардан тұратын сұйықтықпен ауыстырылады.
Димсперсті фаза бөлшектерін сұйық ортады немесе сұйықтықтың мембрана капиллярында ауысуын орындайтын элекрлік әрекет ету күшін табайық:
Fэл = qFO (71)
мұндағы, q – зарядтың беткі бөлік тығыздығы;
O – беткі бөлік ауданы;
F – қарсыласу күші.
(1) – формуласы бөлшектің электрофоретикалық қозғалысын сипаттауда және сұйықтықтың электроосмостық қозғалысын сипаттауды қолданылады. Егер қозғалыс жылдамдығы тұрақталса, онда электроосмостық әрекет ету күші ортаның қарсыласу күшіне Fқарс тең болады. Соңғы күш Ньютон заңы бойынша анықталады:
Fқарс = 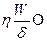 (72)
(72)
мұндағы, 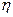 - сұйықтықтың тұтқырлығы;
- сұйықтықтың тұтқырлығы;
W – фазааралық ауысудың қатыстық жалдамдығы;
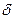 - қасарланған электр қабатының қалыңдығы;
- қасарланған электр қабатының қалыңдығы;
О – қасарлынған электр қабатының ауданы.
(2) – формуласын қолдана отырып фазаның қатыстық ауысуын былай сипаттауға болады. Қосарланған электр қабатының ішіндегі сұйық орта екі беткі бөлік арасында майлағыш ретінде жүреді. Майлағыш тұтқырлығы бір қабаттың екіншісіне ауысуы арқылы жоюға міндетті қарсыласу күшін анықтайды.
(71) және (72) формулалары бөлшектің электрофоретикалық қозғалысын және сұйықтың электроосмостық ағымы үшін де қолданылады.
Бөлшектердің электрофоретикалық жылдамдығы және сұйықтың электроосмостық ағымы немесе Квинке мен Дорнның эффектісімен өлшенетін электрокинетикалық потенциал немесе 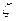 - потенциал мына қатынастағы заряд тығыздығымен байланысты:
- потенциал мына қатынастағы заряд тығыздығымен байланысты:
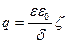
Жоғарыдағы формулаларды қорыта келе мынаны аламыз:
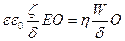
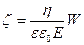
(73)
немесе, 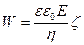 (74)
(74)
(74) – формуласы 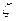 - потенциалын анықтау үшін қолданылады, егер дисперсті фаза цилиндірлік бөлшектрерден тұратын болса. Сферикалық бөлшектер үшін басқа формуланы шағарайық. Тұтқырлы сұйықтықтың қарсыласу күші ондағы сферикалық бөлшектердің қозғалуына байланысты Стокс формуласы бойынша анықталады:
- потенциалын анықтау үшін қолданылады, егер дисперсті фаза цилиндірлік бөлшектрерден тұратын болса. Сферикалық бөлшектер үшін басқа формуланы шағарайық. Тұтқырлы сұйықтықтың қарсыласу күші ондағы сферикалық бөлшектердің қозғалуына байланысты Стокс формуласы бойынша анықталады:
Fқарс = 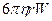
Электростатикалық әрекет ету күші беткі бөлік зарядына Q –ге тең болады:

Fэл = QE
Қос электр қабатымен қоршалған бөлшекті сферикалық конденсатор ретінде қарастыруға болады. Егер ішкі сфераның радиусы r, ал сыртқы (r + 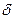 ), бұндағы
), бұндағы 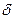 - қос электр қабатының қалыңдығы, онда конденсатор сыйымдылығын мына формуламен анықтайды:
- қос электр қабатының қалыңдығы, онда конденсатор сыйымдылығын мына формуламен анықтайды:
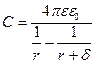
Беткі бөлік зарядын және электроосматикалық әсер ету күшін табамыз:
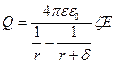 ,
,
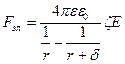 .
.
Fқарс және Fэл күшін теңестіру нәтижесінде мынаны аламыз:
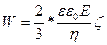 ,
,
және 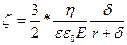
Егер қос электрлі қабаттың қалыңдығы бөлшек көлемінен айтарлықтай үлкен болса, онда r 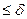 . Бұл жағдайда жай формулаларды қолдануға болады:
. Бұл жағдайда жай формулаларды қолдануға болады:
 W =
W = 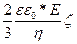 ,
,
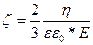 W
W
Жалпы бұл теңдеу бөлшектерді электрофоретикалық қозғалысын сипаттайды:
W = 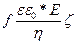 (75)
(75)
Мұндағы, f – сандық көбейткіш.
(75) теңдеуіне Э.Хюккель және Д.Генри анализ жүргізді. Олар электрлік аумақтың қозғалысы кезіндегі иондар қозғалысы жайлы зерттеді.
Бөлшектің қозғалысына қарама-қарсы дисперсті орта иондары бөлшектердің ауысуына кедергі келтіреді.
Радиусы ri болатын копилляр арқылы өтетін сұйықтың көлемі мынаған тең:
Vi = 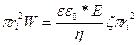 (76)
(76)
Мембрана арқылы өтетін сұйықтың көлемін бүкіл капилляр көлемінің суммасы бойынша анықтаймыз: 
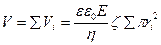 (77)
(77)
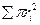 - сумасынан құтылу үшін келемсі әдіст
- сумасынан құтылу үшін келемсі әдіст  і пайдаланамыз. Мембрананы капиллярдың паралельді қосылған өткізгіші ретінде қарстырамыз. Мембрананың электрлік қарсыласуын- R мына формуладан табамыз:
і пайдаланамыз. Мембрананы капиллярдың паралельді қосылған өткізгіші ретінде қарстырамыз. Мембрананың электрлік қарсыласуын- R мына формуладан табамыз:
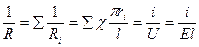
мұндағы, Ri – бір капиллярдың қарсыласуы;
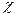 - капиллярдағы сұйықтықтың электр өткізгіштігі;
- капиллярдағы сұйықтықтың электр өткізгіштігі;
l – капилляр ұзындығы;
I – тоқ күші;
U – кернеу.
Содан,

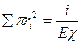
Нәтижесінде:
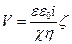 (78)
(78)
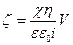 (79)
(79)
(78) және (79) теңдеулері келесі шарттарды орындағанда жүзеге асады: а) қос электр қабатының қалыңдығы капилляр радиусынан едәуір ауыр; б) капилляр қабырғасының электр өткізгіштігі ерітіндінің электр өткізгіштігімен салыстырғанда аз болады.
Аудан бөлшегінің өзгеруі
 Жіңішке поралы мембрананы қолданған кезде бірінші шарт бұзылады. 38- ші суретте аудан бөлшегі қалай өзгеретіні схеме түрінде көрсктілген. Ол өскен сайын целиндр арқылы өтетін сұйықтық шығыны азаяды.
Жіңішке поралы мембрананы қолданған кезде бірінші шарт бұзылады. 38- ші суретте аудан бөлшегі қалай өзгеретіні схеме түрінде көрсктілген. Ол өскен сайын целиндр арқылы өтетін сұйықтық шығыны азаяды.
Оның нәтижесінде, қабынған бөлшек концентрациясы сұйықтың көлемі бойынша концентрациясынан үлкен болады. Сондықтан, капиллярдағы ерітіндінің электр өткізгіштігі сұйықтың орташа электр өткізгіштігін жоғарылатады. Бұл құбылыс беткі бөліктің электр өткізгіштігі деп аталады және электроосмостық эффектісі дәл сипатталғанкезде есептеледі. Егер мембрананы горизонталь орналастырса, онда электроосмос деп аталатын гидростатикалық қысымның өткізгіштігін бақылауға болады.  - потенциал мен электроосмостық қысым арасындағы тәуелділікті электроосмостық қозғалыс және гидростатикалық қысым әсерінің нәтижесінде болатын тасқында түзету арқылы табамыз. Бір капиллярға арналған бірінші себеп мына формуламен анықталады
- потенциал мен электроосмостық қысым арасындағы тәуелділікті электроосмостық қозғалыс және гидростатикалық қысым әсерінің нәтижесінде болатын тасқында түзету арқылы табамыз. Бір капиллярға арналған бірінші себеп мына формуламен анықталады
Хаген- Пуазейя теңдеуі бойынша қарсы тасқынды анықтаймыз:
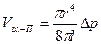
мұндағы, l – капилляр ұзындығы.
Тасқын теңелген кезде мына теңдеу шығады:
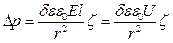 (80)
(80)
Осының нәтижесінде электроосмостық қысым - 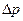 , кернеумен – U анықталады.
, кернеумен – U анықталады.
Физика курсынан мынандай жайттар белгілі. Егер, тұтқырлығы η\- ға тең сұйық бойында радиусы r - ге тең шар тәріздес белшектер ерітілген болса, онда олар өз ауырлық күшінің әсерінен, шөгу барысында, сұйық бойынан Ғ - ке тең қарсы кедергі күшін сезінеді, яғни:
F = 6πrηυ Мұндағы: η -орта тұтқырлығы;
υ- радиусы г-ге тең шар тәріздес бөлшектерінің қозғалыс жылдамдығы.
Сұйықтың тығыздығын "ρ", ал ерітілген заттың тығыздығын "d", еркін түсу үдеуін "g" деп қабылдасақ, әрбір шар тәріздес бөлшектің салмағы мына формулалар арқылы анықталар еді:
P = mg; m = V· ρ; V = 4 / 3πr3 P =4 / 3πr3 (d – p)g
Сұйық бойындағы кедергі "Ғ" күші мен олардың ауырлық "Р" күші тең болса, ерітінді бойында мына теңдік орынды:
6πrηυ = 4 / 3πr3 (d – p)g
Осы теңдіктен қозғалыс жылдамдығы "υ " шамасын анықталық:
υ= 2/9 r2(d – p)g / η
Мұндағы: г - ерітіндідегі еріген бөлшектер радиусы;
d–ерітілген зат тығыздығы;
р - еріткіш тығыздығы;
g –еркін түсу үдеуі;
η - ерітінді тұтқырлығы.
1. Осы теңдіктен ерітілген зат тығыздығы еріткіш тығыздығынан кіші болса (d–р<0) өрнек теріс мәнге ие болады. Бұл теріс мән, ерітілген бөлшектердің ыдыс түбіне шөгу орнына ерітінді бетіне жиналуға ұмтылатындығын білдіреді. Мысалы, су бойында еріген бензин, керосин, май түйіршіктері.
2. Осы теңдіктегі d–р>0 болса, онда коллоидты ерітінді бөлшектері ыдыс түбіне щөгуге ұмтылады. Ал, бөлшектердің қозғалыс жылдамдығының шамасы оның ірілігіне, яғни радиусының квадратына қарайлас болып келеді, сондықтан аталған шаманың коллоидты ерітінді тұрақтылығын сақтауда айырықша орын алатындығын ес-керген жөн.
Мысалы, диаметрі 2·104 м болатын бөлшектердің шөгу жылдамдығы 0,2 м/сек, ал осы диаметрді жүз есе кішірейтсек, келтірілген шама 2·10-5 м/сек болып шөгу жылдамдығы он мың есе азаяр еді.
Коллоидты ерітінділердің кинетикалық тұрақтылығы ғалым Н.В.Песков - Лаплас - Перреннің гипсометриялық формуласымен - бөлшектердің ерітінді бойында белгілі бір биіктік аралығында таралып орналасуымен сипатталады.
Лаплас-Перреннің гипсометриялық формуласы
төмендегіше жазылады:
NA· V (d- p)gh
n1/ n2 = e  RT
RT
Мұндағы: n1 - ерітіндінің белгілі бір "1" деп белгіленген қабатына сэйкес келетін бірлік көлемдегі бөлшек саны;
п2 - ерітіндінің екінші бір "2" деп белгіленген қабатына сәйкес келетін бірлік көлемдегі бөлшек саны;
п2- қабаты n1 - қабатына қарағанда жоғары орналасады және олардың ара қашықтықтары һ -қа теңеледі.
NA - Авогадро тұрақтысы - 6,02·1023 мол ';
V - жеке алынған коллоидты бөлшек көлемі;
d - бөлшек тығыздығы;
р - ерітінді тығыздығы;
g - еркін түсу үдеуі.
Лаплас - Перреннің формуласын екі жағын да логарифмдеп пайдалану ыңғайлы, яғни:
NA· V (d- p)gh
ln n1/ n2 =  RT
RT
немесе
ln n1/ n2 =V/ 2,3 (d-p)gh; R / NA = k
Салыстырмалы n1/ n2 - қатынасын әртүрлі зольдер үшін анықтай отырып, коллоидты ерітінділердің кинетикалық тұрақтылығын өзара салыстыруға болады. Сонымен қатар, ара қашықтық биіктікті пайдалана отырып, нақты коллоидты жүйе бөлшектерінің шамасын бағамдауға болады. Мысалы, жер бетімен салыстырғанда 5 км -дей биіктікте оттегі концентрациясы екі есе азаятынын, ал 100 км биіктікте миллион есе азаятындығын есептеп табуға болады.
1 - мысал. Тығыздығы 19,3 г/см3 болатын бағалы металды-тығыздығы 1,02 г/см3, су ортасында-электрлік доға әдісімен ұнтақтау арқылы оның гидрозолизін алды. Қоллоидты ерітінді бойындағы бөлшектер саны 8,56 см биіктік аралығында "е" есе өзгереді. Осы колдоидты бөлшектердің радиусын анықтаңыз. Жүйе температурасы 293К.
Талдау. Коллоидты бөлшектердің кинетикалық тұрғыда тұрақтылығы бойынша олар ерітінді бойында Лапласс - Перреннің гипсометриялық формуласына сәйкес таралып орналасады, яғни:
ln n1/ n2 =V / kT (d - p)gh
Егер, коллоидты бөлшектердің пішінін шар тәріздес деп қабылдасақ, онда бұл бөлшектердің көлемімен, радиусы арасындағы байланыс өзімізге таныс формуламен беріледі:
V = 4 / 3 πr2
Олай болса, Лаплас-Перреннің формуласындағы V орнына 4 / 3 πr2 өрнегін қойып, бөлшек радиусын оңай есептеп табуға болады. Ол үшін,есеп шартында берілген физикалык шамаларды жазып алайық та, сан мәндерін орнына қойып есептеуге көшелік.
4.5.3. Агрегативті немесе құрылымдық тұрақтылық. Коллоидты ерітінділер тұрақтылығын сипаттауда жоғарыда атап өткеніміздей, ерітілген зат бөлшектерінің ірілі - ұсақтығы, яғни дисперстілігі, басты көрсеткіш болып табылатындығына көз жеткіздік.
Ерітінді бойындағы бөлшектердің өзара соқтығысу барысында бірігіп, іріленіп дисперстілікті өзгертуі - коллоидты жүйенің агрегативтік тұрақтылығының кемігендігін айғақтайды. Коллоидты бөлшектер өзара бірігуі үшін мицелла құрамындағы "коллоидты бөлшек" немесе "гранула" потенциалы нольге теңелуі тиіс. Бұл потенциал - дзета потенциал немесе электрокинетикалық потенциал екендігі белгілі. Демек, коллоидты бөлшектерге агрегативті тұрақтылық беретін күш төркінінің бірі оның дзета потенциалының болуы. Аталған шама нольге теңелгенде, яғни изоэлектрлік жағдай кезінде бөлшектер бір-біріне мейлінше жақындап біріге алады деп қабылданады. Алайда, кейде дзета потенциал нольге теңелгенімен, коллоидты жүйелер өз тұрақтылығын сақтап қалған жағдайлар жиі ұшырасады. Бұл құбылысты оқымыстылар агрегат пен ядроға тартылған иондардың сольваттану қабатіе түзумен байланыстырады.
Коллоидты бөлшек бойындағы қос иондық қабаттың сығылуы- оның сольваттану дәрежесінің кемуіне әкеліп соқтырады. Сольваттанған иондар шамасының кемуі сольваттану қабатын да жұқартады.
Ал, сольваттану қабаты, коллоидты ерітінділер тұрақтылығын анықтауда басты көрсеткіштерінің бірі болып саналатынын мына шамалардан аңғартуға болады.
Тұрақтылығы жоғары зольдерде сольваттық қабат қалыңдығы –10-8 м және одан жоғары. Дзета потенциалы нольге тең коллоидты бөлшектерде сольваттық қабат қалыңдығы ~ 10-10 м ғана және бұл жүйелер ылғи да тұрақсыз болып келеді.
Сонымен, коллоидты жүйелерге құрылымдық немесе агрегативті тұрақтылыққа негіз болатын күштер қатарына олардың дзета потенциалы жэне сольваттың ңабатының болуы жатқызылады.
Коллоидты ерітінді бөлшектерінің ңұрылымын өзгертіп, өзара бірігіп,іріленуі нәтижесінде тұнбага көшуі — олардың коагуляциясы – ұюы деп аталады.
Ерітілгвн бөлшектер сұйық кұйінде болып, олар сұйық бойында бірігі,іріленсе - коалесценция деп аталынады.
Мысалы, қаймақтан май алу немесе сүттің іріуі сияқты өзгерістер.
Коллоидты ерітінділерді ұйыту үшін жүйеге сырттан күшпен әсер етеді, қыздырады немесе тоңазытады, электролит ерітіндісін қосады.
Коллоидты ерітінділердің ұюына электролит қосудын орны ерекше.
Енді, коллоидты ерітінділерге электролит әсерін қарастыралық.
4.5.4. Коллоидты ерітінділерге электролит әсері. Коллоидты ерітінділердің жай-күйіне сырттан қосылған злектролиттер қатты әсер етеді. Қосылган электролиттер коллоидты бөлшектердің құрылымын өзгертіп, олардың коагуляциялануына, бір-бірімен бірігіп тұнбаға көшуіне итермелейді. Міне, осындай өзгерістер орын алу барысында тәжірибе жүзінде жинақталған тұжырым - ережелермен танысалық.
1. Кез-келген электролитті коллоидты ерітінді құрамына қосқан кезде коллоидты бөлшектердің де құрылымына әсер етеді.
Коллоидты ерітіндідегі бөлшектердің құрылымын өзгертіп, оның коагуляциялануына қажетті электролиттің ең аз концентрациясы "ұйытудың шекті мәні" немесе "үйыту шегі" деп аталады. Орыс тіліндегі "порог коагуляции" ұғымын құбылыстың мән-мазмұнын ескере отырып "ұйытудың шекті мәні" немесе "үйыту шегі" деп баламалы түрде аудардық. Кейбір оқулықтарда "үйыту табалдырығы" деген анықтамалар да ұшырасады. Коагуляциялану, ұю бір-біріне баламалы ұғымдар.
Ұйытудың шекті мәні γ, Ск - таңбаларымен белгіленеді де, ммоль/л, моль/л, моль/м3 бірліктерімен өлшенеді. Ал есептеу үшін төмендегі
γ =Vэ∙C / V+Vэ немесе γ =n / V+Vэ
Мұндағы: Vэ - ұйытуға алынған сырттан қосылатын электролит көлемі, л, м3;
V - золь көлёмі, л, м3;
С - электролит концентрациясы, моль/л, моль/м3;
n - электролитте еріген зат мөлшері, моль
.Ұйытудың шекті мәніне кері шама электролиттің "ұйыту қабілеті" (коагулирующая способность) деп аталады да Vк таңбасымен белгіленеді:
Vк = 1 / γ
1 - мысал. 1 -10-2 м3 шайынды су құрамындағы иодты күміс зольін ұйыту үшін тығыздығы 1,07-103 кг/м3 10% 8-10-4 м3 ас тұзының ерітіндісі пайдаланылады. Натрий хлориді ерітіндісінің ұйыту шегін анықтаңыз.
Шешімі: Тығыздығы 1,07 - 103 кг/м3 10% 8-10-4м3 ас тұзы ерітіндісіндегі хлорлы натрий мөлшерін есептелік. Ерітінді массасы: 1,07∙103 • 8∙10-4 = 0,856 кг = 856 г.
Хлорлы натрий мөлшері:
856∙10/100∙M(NaCI)=85,6/58,5=1,46 моль
Электролиттің үйыту шегін анықталық:
γ = n / V+Vэ =1,46 / 1∙ 10-2 + 8∙10-4 = 1,46 / 1,08∙10-2= 135 моль/м3
Демек, шайынды су бойындағы күміс иодиді зольін ұйыту үшін пайдаланылған ас тұзы ерітіндісінің ұйыту шегі:
135моль/м3.
Енді осы мысалды пайдалана отырып ас тұзы ерітіндісінің "ұйыту қабілетін" анықталық.
Формула бойынша
Vк = 1 / γ
Демек, Vк = 1 / 135 = 7,4∙10-3м3/моль
Кез-келген золь ерітіндісінің ұюын оның түсінің өзгеруімен, лайқаланылуымен және дисперсті фазаның тұнбаға көшуінен байқауға болады.
2. Зольді ұйыту үшін пайдаланылатын электролит құрамындағы ионның заряд таңбасы коллоидты бөлшектің потенциал анықтауыш ион таңбасына қарама-қарсы болуы тиіс. Аталған ион зарядының шамасы артқан сайын оның ұйыту қабілеті де артады. Бұл заңдылық Шульце-Гарди ережесі деп аталады да төмендегіше тұжырымдалады.
Ұйыту шегінің ең кіші мәнізаряды үлкен ионға сәйкес келеді және олардың арасындағы байланыс мына теңдікпен өрнектеледі:
γ = Сопst / z6 (11)
→Мұндағы z-ион заряды.
Шульце-Гарди ережесіне органикалық тектегі иондар
бағынбауы да мүмкін. Органикалық иондардың ұйыту
қабілеті олардың адсорбциялану бейімділігінің өсуімен ар-
тады.
Зарядтары бірдей иондар үшін, олардың гидратацияла-
ну дәрежесі кему бағытында ұйыту қабілеті де артады.
Мысалы: Li+ Na+ K+ Rb+
CI Br- I- CNS-
Гидратациялану дәрежесі кемиді
 Ұйыту қабілеті артады
Ұйыту қабілеті артады
Мұндай катарлар "лиотропты қатарлар" немесе "Гоф-мейстер қатары" деп аталынады.
5. Көпшілік зольдердің ұюы олардың дзета потенциал
мәндерінің ~ 30 мВ төңірегінде бастала береді.
6. Ұйыту барысында электролиттер қоспасы пайдала-
нылса олардың әсері әртүрлі больш келеді.
- электролиттердің ұйыту әсері олардың ұйыту шекті
мәндерін қосу арқылы анықталады (арифметикалық қосу).
Аталған электролиттер қатарына ион зарядтары бірдей және
гидратациялану дәрежесі өзара жуық иондар жатады (КСІ +
КNO3, КСІ +NaCI );
- электролиттер қоспасы бір-бірінің ұйыту қабілетін көп
төмендетіп жібереді және бұл антогонизм әсері деп аталады.
Мысалы, күміс иодиді зольін А1(NО3)3 + К2SО4 немесе
Ті(NО3)4 + Nа2SО4 қоспаларымен ұйытқанда антогонизм
әсері орын алады;
- электролиттер қоспасы бір-бірінің ұйыту қабілетін жеке-
жеке алғандығыға қарағанда арттырады және бұл синергизм
әсері деп аталады.
7. Коллоидты бөлшектерінің заряд таңбалары қарама-қарсы болып келген екі золь өзара қосылғанда коагуляцияға ұшырайды.
Зольдердің бір-бірімен қосылғанда өзара ұю құбылысының орын алуы табиғатта жиі ұшырасады. Мысалы өзен арасындағы лайқа батиақтардың түзілуіне бірден-бір себепші құбылыс өзен суы мен теңіз суының араласуы. Теңіз тұздарының иондары өзен суының коллоидты бөлшектеріне адсорбцияланады да, олардың тұнба болып шөгуіне итермелейді. Осының нәтижесінде өзен арналарының түбінде лай батпақ түзіледі.
Зольдерді ұйытуда электролит иондары зарядының әсері Шульце-Гарди ережесінде айтылды.
Сол айтылғандар түсінікті болу үшін 1 -мысалды 2 - мысалмен толықтыралық.
2 - мысал. Дәл 1 - мысалдағыдай хлорлы күміс зольінің ерітіндісі берілген. Бұл орайда золь оң зарядталған болсын, көлемі 100 м3 шайынды су құрамындағы хлорлы күмістің ұйыту үшін тығыздығы 1,30∙103 мг/м3 28% алюминий сульфатының қанша текше метр ерітіндісі қажет?
Шешімі: Коллоидты бөлшектің заряды оң болғандықтан ұйытушы ион алюминий сульфатының теріс таңбалы сульфат анион-дары болып табылады.
Сульфат ионының заряды екіге тең. Ұйыту шекті мәні және заряд шамасының арасындағы формуланы пайдалана отырып, сульфат иондары үшін ұйытудың шекті мәнін анықтаймыз:
γ = Сопst / z6
Олай болса: бір зарядты ион үшін γI= Сопst/ 16= Сопst
Екі зарядты ион үшін γII= Сопst/ 26= Сопst/64
1 - мысалдан электролит ретінде ас тұзының ерітіндісін қолданғанымызда ұйытудың шекті мәні 135 моль/м болғанын білеміз. Ендеше осы мәліметтерді пайдалана отырып γII – анықталық:
γI/ γII= Сопst/ Сопst/64; 135/ γII=64; γII= 135/64=2,12 моль/м3
Демек, 100 м3 шайынды судағы күміс хлориді зольін ұйыту үшін 2,12∙100 = 212 моль SO4 иондары қажет.
Енді 212 моль сульфат ионы алюминий сульфатының қандай мөлшерінде болатынын есептелік.
AI2(SO4)3←→2AI3+ + 3SO42-
Алюминий сульфатының бір мольінен үш моль сульфат ионы түзіледі екен. Олай болса 212 моль сульфат ионы алюминий сульфатының қандай мөлшерінде бар лекендігін есептеік.
n[AI2(SO4)3]= 212/3= 70,7 моль
28% AI2(SO4)3 ерітіндісінің көлемін табу үшін алюминий сульфатының массасы анықталық
m[AI2(SO4)3]=M[AI2(SO4)3]∙ n[AI2(SO4)3]=342∙70,7= 24179г.
m[AI2(SO4)3]=24б2кг.
24,2 кг алюминий сульфаты тығыздығы 1,3 • 103 кг/м3 массалық үлес концентрациясы 28% болатын ерітіндінің қандай көлемінде болатынын есептейміз.
100 кг ерітінді – 28 кг AI2(SO4)3
Х кг ерітінді – 24,2 кг AI2(SO4)3
Х= 100∙24,2 / 28= 86,4 кг ерітінді
Ерітінді көлемін есептеу үшін ерітінді тығыздығын пайдаланамыз.
m(ерітінді)=Vp; V = m(ерітінді) / p
V = 86,4 / 1,3∙103 = 66,46 ∙10-3 м3 = 6,65∙10-2 м3
3 - мысал. Жоғарыдағы мысалда келтірілген золь ерітіндісінің коллоидты бөлшектері теріс зарядталған болсын. Осы жағдайдағы алюминий сульфаты ерітіндісінің ұйытуға қажетті көлемін анықта.
Шешімі: Коллоидты бөлшек таңбасы теріс болған соң оның мицелласының формуласы төмендегідей түрде болады:
{m(AgCI) ∙nCI- ∙(n – x) Na+ }- xNaCI
Зольді ұйытуға потенциал анықтауыш ион таңбасына қарсы таңбадағы алюминий иондары қатынасып, дзета потенциал шамасын төмендетеді.
Электролит ионының заряды және оның ұйыту шекті мәні арасындағы формуланы пайдалана отырып, алюминий ионы үшін γIII-ті анықтаймыз:
γI/ γIII= Сопst∙(zIII)6 / Сопst∙(zI)6; 135 / γIII= 36 / 16
γ= 135 / 729= 0,186 моль/м3
Алюминий иондарының 100 м3 шайынды судағы хлорлы күмісті ұйытуға қажетті мөлшерін есептейміз:
n(AI3+) = γIII∙ V = 0,186∙100= 18,6 моль
Енді 18,6 моль А13+иондары алюминий сульфатының қандай мөлшерінде болатынын анықтаймыз:
AI2(SO4)3←→ 2AI3+ + 3SO42-
1 моль 2 моль
Пропорция құрамыз:
1моль AI2(SO4)3 – 2 моль AI3+
х моль AI2(SO4)3 - 18,6 моль AI3+
х = 18,6 / 2 = 9,3 моль AI2(SO4)3
Алюминий сульфатының 9,3 моль мөлшерінде сәйкес келетін массасын есептейміз:
m[AI2(SO4)3 ] = M[AI2(SO4)3] ∙ n[AI2(SO4)3]
m = 342 ∙ 9,3 = 3180,6 г немесе 3б18 кг AI2(SO4)3
3,18 кг алюминий-сульфаты бар массалық үлесі 28%-ке тен ерітінді массасын анықтаймыз:
100 кг – 28 кг AI2(SO4)3
х кг – 3,18 кг AI2(SO4)3
х = 100∙ 3,18 / 28 = 11,35 кг ерітінді
Ал енді ерітінді көлемі, оның тығыздығы белгілі болса, оп-оңай төмендегіше есептеледі:
V= m (ерітінді) / p = 11,35 / 1,3∙ 103 = 8,74∙ 10-3м3
Тестік тапсырма
1. Хлорлы күміс зольі артық мөлшердегі ас тұзы қатысуында алынды. Ұйытуға қай электролит тиімді: KNO3, Ca(NO3)2, K3PO4?
a. KNO3 б. Ca(NO3)2 в. K3PO4
2. Потенциал анықтауышы ионы оң зарядты зольді ұйытуға қай ион тиімді: Ca2+, NO3 K+, PO43-, AI3+, SO42-?
a. Ca2+, NO3 б. PO43-, SO42- в. K+, AI3+
3. Золь дзета потенциалы нольге теңелсе де коагуляция-ланбауына нендей фактор әсер етеді?
а. температура б. адсорбциялы-сольваттық қабат, в.қысым
4. Коллоидты ерітінділердің тұрақтылығыша қыздыру қалай әсер етеді?
а. тұрақтылығы тек артады
б. тұрақтылығына оң да кері де әсер етуі ықтимал
в. әсер етпейді
5. Ұйыту шекті мәні 100 моль/м3. Ұйыту қабілетің
анықта.
а. 100 б. 1∙10-2 в. 1
6. Коллоидты бөлшек теріс зарядталған. Бір валентті ка-
тионы бар электролитпен ұйытқанда ұйытудың шекті
мәні 128 моль/м3. Осы шама екі валентті катионы бар
электролитті қолданса қанша болады?
а. 64 ә. 2 б. 32
7. АgСІ тұнбасы берілген. Қай электролит иондары
жақсы адсорбцияланады: K2CO3, KNO3, Ba(NO3)2, K2SO4
а. Ba2+, K+ ә. CO32-, SO42- б. K+, NO3-
Дұрыс жауап реті ә - бағанына сай келеді.
4.5.5. Коллоидты ерітінділердің тұрақтылыгы ДЛФО теориясы. Коллоидты ерітінділердің тұрақтылық теориясын дамытқан Б.В.Дерягин, Л.Д.Ландау, Э.Фервей және Я.Овербек сынды ғалымдар болды. Осы оқымыстылардың фамилияларының бас әріпінен, олар дамытқан көзқарасты ДЛФО теориясы деп атайды.
Бұл көзқарас бойынша кез-келген екі бөлшек молекула аралық әсерлесу күштері нәтижесінде тартылыста және тебілісте болады. Коллоидты бөлшектердің бір-біріне тартылу және тебілу күштерінің шамасын олардың ара қашықтықтарын өзгеруіне байланысты есептей отырып, суреттегідей бейнедегі тәуелділік сызығын алады.
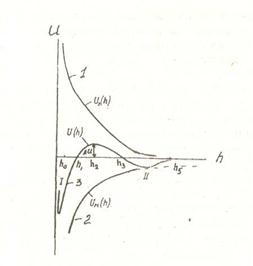
13-сурет.
Коллоидты бөлшектердің бір-біріне тартылуының олардың ара қашықтықтарының өзгеруіне байланыстылығы
Коллоидты бөлшектердің өзара әрекеттесуінің потенциалды қисық сызықтары 1-бөлшектердің өзара тебісу энергиясын бейнелейтін тәуелділік;
2- бөлшектердің өзара тартылу энергиясын бейнелейтін тәуелділік; 3- бөлшектердің тебісу және тартылу энергиясын қоса ескеретін тәуелділік сызығы.
Мұндағы, бірінші сызық коллоидты бөлшектердің тебісу энергиясын сипаттайтын қисық. Екінші түрдегі қисық бөлшектердің өзара тартылуын сипаттайды. Ал үшінші сызық осы бөлшектердің тебілуі және тартылу энергияларын ескере отырып тұрғызылған тәуелділік. Бұл тәуелділік тебілу және тартылу энергия шамаларын қосу арқылы тұрғызылады, яғни:
U = Uэ+ U M Be –xh – A / h2
Мұндағы:
Uэ - бөлшектердің электростатикалық тебілу энергиясы;
U M — бөлшектердің молекулааралық тартылу энергиясы;
һ - бөлшектердің ара қашықтығы;
х - диффузиялық қабат қалыңдығына кері шама;
В - қос иондық қабат потенциалына тәуелді шама;
А – молекулааралық тартылыс күштерін сипаттайтын тұрақты шама.
Суреттегі ∆Uδ - коллоидты бөлшектердің тұрақтылығын сипаттайтын энергетикалық асу. Бұл кәдімгі Аррениус теориясындағы активтендіру энергиясы сияқты шама. Химиялық реакция басталып өнімге айналу үшін энергетикалық тосқауылдағы Е шамасын асып өтетіндей, коллоидты бөлшектер бірігуі үшін, ∆Uδ шамасын асуы қажет.
Коллоидты бөлшектер энергиясы 1,5кТ болсын. Ара қашықтық һ–мәнін кішірейтіп коллоидты бөлшектерді өзара жақындастырғанда, олар, ∆Uδ -ға тең энергетикалық тосқауылға кез болады. Егер, 1,5кТ мәні ∆Uδ – дан жоғары болса.бөлшектер һ0 - һ, қашықтығында өзара бірігіп, тыныштық I - күйге көшеді.
Агрегативтік тұрақтылық бұзылып, коллоидты ерітінді бастапқы күйін жоғалтады.
Бөлшектердің кинетикалық энергиясы ∆Uδ шамасынан кем болса, һ,-һ аралығында тебіліс энергиясы басым болғандықтан, коллоидты жүйе - өз күйін ал, мицелла-өз құрылымын сақтайды. Ал, коллоидты бөлшектер ара қашықтығы Һ3-h3 аралығында жатса, олардың арасында тартылу күші басымдау келеді де, ІІ -энергетикалық минимумге сәйкес келетіндей күйге көшеді. Бұл жағдай бөлшектер өзара бір-біріне жақын жуықтап келе де алмайтын және бірін-бірі тастап кете алмайтындай байланыста болатын іркілдек-гель жағдайына сәйкес келеді. Алайда өзара байланысы әлсіз құрылымды оп-оңай қозғау, шайқау немесе сілкілеу арқылы бұзуға болады. Демек, өзара құрылым түзе бастаған жүйенің тыныштығын бұзып, оның бөлшектеріне қайтадан бағыт-бағдарсыз коллоидты ерітіндіге тән көзі алысқа келтіруге болады. Осы жүйе, уакыт өте оған сырттан күш әсер етпесе, қайтадан құрылым түзеді. Міне осындай коллоидты ерітінді (золь) -> гель —>золь→ гель құбылыстары тиксотропия деп аталады.
Мысалы, суармалы егістік жерлерде тиксотропия әсерінен құнарлы топырақ бетін батпақты - лай көшкіндері басып көп зиян келтіреді. Таулы аймақтарда аталған құбылыстың әсерінен тіршілікке қауіпті жойқын лайқа топырақ-жер қыртысының көшкіндері де ұшырасып отырады.
Демек, коллоидты жүйелер тұрақтылығын сипаттау барысында оны құрайтын бөлшектердің ара қашықтығы, кинетикалық энергиясы және осы құрылымға сәйкес келетін тартылыс - тебіліс энергиялары басты көрсеткіш болып табылады. Олай болса, коллоидты жүйедегі дисперсті фазаны құрайтын бөлшектер концентрациясы олардың тұрақтылығына үлкен әсер етеді.
Дисперсті фазаның коллоидты бөлшектерінің концентрациясы артуынан жүйенің коагуляцияға ұшырауы қыспақты (стеснения) коагуляция деп аталады.
Коллоидты жүйелерде бөлшектердің өзара әсерін һ5 - тен кейінгі қашықтықта ескермеуге болады.
Ал, бөлшектер өзара әсерлесуде болған жағдайда жүйе қандай дәрежеде тұрақты болады?!
Осы мәселені жақсы меңгеру үшін ДЛФО теориясына бір мысал қарастыралық.
1- мысал. Күміс хлоридінің зольі берілген. Мицелла формасы шар тәріздес, ал шар радиусы 100 нм. Артық алынған электролит ас тұзы. Коллоидты бөлшектің электрофорез бойынша анықталған дзета потенциал шамасы 20 мВ. Гамакер константасы А* = 0,5∙10-19Дж. Диффузиялық қабаттың қалыңдығына кері шама х= 1∙108 м-1. Температура 293К. Коллоидты бөлшектер арасы 2; 5; 10; 20 жэне 40 нм болған жағдайларда әсерлесу энергиясын анықтаңыз.
Шешімі: ДЛФО ұсынған тұрақтылық теориясы негізінде ара қашықтық 50 нм кем болса, онда әлсіз зарядталған бөлшектердің әсерлесу энергиясы мына формуламен есептеледі:
U = Uэ+ U M= 2πε0εrξ2 ln(1+e-xh) – Ar / 12h
Мұндағы: Uэ - бөлшектердің электростатикалық тебіліс энергиясы;
U M - бөлшектердің молекулааралық тартылыс энергиясы;
ε 0 - электрлік түрақты 8,85-10-12 Ф/м;
ε - диэлектрлік тұрақғы шама, су үшін 81.
һ = 2 нм. U - шамасын есептелік.
Uэ =2∙З,14∙8,85∙10-12 ∙81∙1∙10-7 (2∙10-2) ln(1+e-0,2) = 10,77∙ 10-20Дж
U M= -- 0,5·10-19·10-7/12·2·10-9= - 20,83·10-20 Дж
U = 10,77·10-20 – 20,83·10-20 = - 10,06·10-20 Дж
Дәл осылай етіп өзге ара қашықтықтар үшін де энергиялар шамаларын есептеп, кесте толтырамыз.
Осы мәліметтерді пайдалана отырып, энергияның ара қашықтыққа байланысты потенциалдық энергия сызығын тұрғызамыз.
Суреттен көріп отырғанымыздай бөлшектер 5-20 нм аралығында өз құрылымдарын сақтап коллоидтық ерітінді күйінде жүреді. Бөлшектер арасын 5 нм ден кішірейту, олардың бірігуіне әкеліп соқтырады. 20-40 нм аралығында бөлшектер әлсіз құрылымдық (тиксотропиялық) байланыста болуы мүмкін.
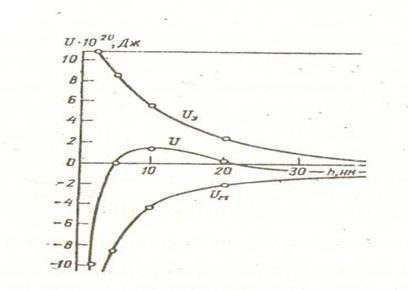
14-сурет.
Потенциалдық энергия қисығы
4.5.6. Коллоидты ерітінділердің ұю теориялары. Г.Фрейндлихтың адсорбциялық ұю теориясы. Адсорбциялық ұю теориясы-коллоидты бөлшектер бетіне иондардың адсорбциялануын негізге алады.
Иондардың коллоидты бөлшектер бетіне адсорбциялануы Фрейндлихтың адсорбциялану теориясындағы изотерма теңдеуімен синатталады, яғни:
A = K· C1/n
 Мұндағы: А - адсорбция шамасы;
Мұндағы: А - адсорбция шамасы;
С - адсорбцияланатын зат концентрациясы;
К,1/n - тэжірибе жүзінде анықталатын тұрақты шамалар. Егер, С=1 моль/л болса, онда А=К, яғни концеитрация мәні бірге тең болғанда адсорбция шамасы тұрақты "К" - мәніне теңеледі.
Коллоидты бөлшектер иондарды адсорбциялау барысында потенциал анықтауыш иондар зарядын бейтараптап дзета потенциал мәнін төмендетеді.
Алайда, бұл көзқарас, тәжірибеде ұшырасатын кейбір жәйттерді түсіндіре алмады. Адсорбцияланған иондар мөлшерімен изотерма теңдеуіндегі мәні сәйкес келе бермеді. Сонымен қатар, дзета потенциал шамасын диффузиондық қабаттағы иондар концентрациясын өзгерту арқылы реттеуге болатындығына назар аударылмады.
Г.Мюллердің электростатикалық ұю теориясы.
Ұсынылып отырған ілімінід Г.Фрейндлих көзқарасынан басты айырмашылығы қосылған электролит, диффузиялық қабаттың сығылуын негізге алды. Диффузиялық қабаттан иондардың қос иондық қабатқа кешуі дзета потенциал мәнін төмендетеді. Дзета потенциал шамасының азаюы коллоидты бөлшектердің агрегативтік тұрақтылығының кемуіне әкеліп соқтырады.
Алайда Г.Мюллер теориясы,сырттан қосылған иондардың адсорбциялануын және олардың қос иондық қабат құрамына кіре алатындығын ескермеді.
ДЛФО-ның ую теориясы
ДЛФО теориясында коллоидты бөлшектердің өзара белгілі бір ара қашықтықта олардьің арасында тебілу күштері басым болатындығы негізге алынады.
Енді осы жүйеге сырттан злектролит қосылсын. Бұл орайда коллоидты ерітінділер өз күйін жоғалтып, коагуляцияға ұшырайды. Орын алған өзгерісті ДЛФО теориясы екі түрлі байыппен түсіндіреді.
1, Қосылған электролит диффузиялық қабатты сығымдап дзета потенциал шамасын өзгертеді. Бұл электролит коллоидты бөлшек ядросындағы потенциал анықтауыш иондар шамасына, яғни р- потенциалға әсер етпейді. Осы тұрғыда электролит қосып қос иондық қабат құрылымын және дзета потенциал шамасын өзгерту арқылы коллоидты ерпінділерді ұйыту - концентрация әсерінен ұйыту деп аталынады.
Сырттан қосылған электролиттер ионы ядроға адсорбцияланбайтын болса, онда оларды индиферентті электролиттер деп атайды.
Коллоидты ерітінділерде электролит қосылғаннан кейін диффузиялық қабаттың сығылуы екі түрлі жағдайда орын алады:
- қарама-қарсы таңбадағы иондар диффузиялық қабаттан қос иондық қабатқа ауысып,дзета потеициал шамасын төмендетеді;
- ерітінді иондық күші артқандықтан қарсы таңбадағы иондардың диффузиялану қабаты сығымдалады. Осының нәтижесінде дзета потенциал шамасы өзгереді, бөлшектердің бір-біріне жақындау мүмкіндігі артады.
Сырттан қосылған электролит иондарының коллоидты бөлшек агрегатындағы иондармен нашар еритін қосылыс түзетіндері ерекше адсорбциялық күштерге ие болады. Жоғарыда келтірілген күміс иодидінің золін қарастыралық.
{m AgJ nJ-(n- x)K+} xK+
Бұл коллоидты бөлшектердің потенциал анықтауыш иондары теріс таңбалы болғандықтан, оны бейтараптандыру үшін оң таңбалы иондар қажет екенін аңғару қиын емес. Күміс немесе иодид ионымен нашар еритін қосылыс түзуге бейім электролиттер қатарына, хлорлы натрий, хлорлы кальций, бромды натрий, күміс нитраты, натрий фосфаты, калий карбонаты сияқты тұздарды жатқызуға болады. Карастырылып отырған жағдайда, оң зарядты иондарды пайдаланып, дзета потенциал шамасын өзгертеміз. Ол үшін күміс нитраты ерітіндісінен қосамыз. Күміс иондары потенциал анықтауыш - иодид иондармен әрекеттесіп оларды бейтараптандырады да, дзета потенциал шамасын өзгертеді. Нәтижесінде, коллоидты бөлшек құрылымы өзгеріп, агрегативті тұрақсыздық - кинетикалық тұрақсыздыққа жалғасады.
Дерягин және Ландау, бейтараптану байыбымен жүзеге асатын ұю барысында электролиттердің "ұйыту шегі" сол ұйытушы - ион зарядының алты дәрежесіне кері пропорционал екендігін анықтады, яғни:
γ = Сопst / z6
Бұл теңдікті және оның оң бөлігіндегі қатынасты былай түсіну керек.
Ұйыту үшін бір, екі және үш зарядты иондарды алатын болсақ, онда олардың ұйыту шекті мәндері төмендегідей қатынаста бола отырып, ұютуға бірдей әсер етеді:
γI: γII : γIII = (1/1)6 : (1/2)6 : (1/3)6 = 1: 1/26: 1/36 = 1: 1/64: 1/ 729 = 729:11:1
Демек, белгілі зольдің ерітіндісінің бірдей мөлшерін ұйыту үшін үш зарядты ионы бар электролитке қарағанда екі зарядты ионы бар электролит он бір есе, ал бір зарядты ионы бар электролит 729 есе көп қажет деген сөз.
Тәжірибе ж
Date: 2015-05-08; view: 4292; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |