
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тұздар
Тұздар – металл атомдарынан және қышқыл қалдығынан тұратын күрделі заттар.. Олардың диссоциациялану теңдеуін иондардың гидратациясын есепке алып: былайша жазу керек:
NaCl (k.)↔Na+ (с.)+С1− (с.) К3РО4 (к.)↔ЗК+ (с.)+ РО  (с.)
(с.)
Құрамына байланысты тұздардың мынадай типтері бар: орташа, қышқыл, негіз, қос және комплексті тұздар. Кезкелген тұзды негізбен қышқылдың әрекеттесуі, яғни нейтралдау реакциясының өнімі деуге болады. Мысалы,
2NaOH + H2SO4 = Na2SO4+2H2O
Орта тұздың Na2SO4 диссоциациялану теңдеуін былай жазуға болады:
Na2SO4↔2Na+ + SO 
Егер негіз күкіріт қышқылын толық нейтралдауға керекті мелшерден аз алынса, онда оны буландырғанда қ ы ш қ ы л т ұ з д ы ң кристалдары түседі:
NaOH + H2SO4 = NaHSO4 + H2O
Қышқыл тұздың диссоциациялануын мына теңдеумен көрсетуге болады:
KHSO4↔K+ + HSO 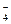
Қышқыл тұзының анионы әлсіз электролиттер тәрізді екіншілей диссоциацияланды:
HSO 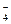 ↔ H+ + SO
↔ H+ + SO 
Көп негізді қышқылдар қышқыл тұздар түзеді. Бір негізді қышқылдар қышқыл тұздар түзбейді.
Н е г і з д і к тұздарды негіздегі гидроксотобы қышқыл қалдығына жартылай алмасқанда алынған өнім деп қарастыруға болады. Мысалы,
Mg(OH)2+HCl = Mg(OH)Cl + H2O
немесе иондық түрде:
Mg(OH)2 + H+ = Mg(OH) + + H2O
Негіздік тұздың диссоциациялануын мына теңдеумен көрсетуге болады:
Mg (OH) Cl↔Mg (OH) + + Cl−
Негіздік тұздың катионы аз дәрежеде әрі қарай диссоциацияланады:
Mg (OH) ↔ Mg2++ ОН−
Демек, негіздік тұздарды көп қышқылды (екі және одан көп) негіздер түзеді. Бір қышқылды негіздер негізгі тұздар түзбейді.
Қос тұздардың молекулалары — әр түрлі металдың ионынан және қышқыл қалдығынан тұрады. Мысалы, KA1(SO4)2, (NH4)2Fe(SO4)2. Мұндай тұздардың диссоциациялануын мына теңдеулермен керсетуге болады:
KAl(SO4)2↔K+ + Al3+ + 2SO42−
(NH4) 2Fe (SO4) 2↔2NH4+ + Ғе2+ + 2SO 
Қос тұздар металдардың ионына және қышқыл қалдығына дис-социацияланады.
Комплексті тұздардың құрамына диссоциация кезінде бөлінетін күрделі (комплекат) иондар кіреді (формулаларда оларды квадрат жақшаға алып жазады). Мысалы:
К4 [Ғе (CN) 6] ↔4К+ + [Ғе (CN) 6]4−
[Ag(NH3)2] Cl↔[Ag(NH3)2] + + C1−
Күрделі (комплексті) иондар одан әрі қарай өте аз дәрежеде диссоциацияланады:
[Fe(CN)6]4−↔Fe2+ + 6CN−;
[Ag(NH3)2] +↔Ag+ + 2NH3
Соньшен, комплексті тұздар диссоциацияланғанда алғашында комплексті иондарды бөліп шығарады, олар одан әрі қарай әлсіз электролиттер тәрізді екіншілей диссоциациялануға ұшырайды.
Тұздардың атаулары. Тұздардың халықаралық атаулары көбірек таралған. Олар екі сөзден: ілік септікте берілген катионның атау септікте берілген анионның атынан тұрады, әдетте, аниондар мен катиондардың саны көрсетілмейді. Ал егер бір металл әртүрлі тотығу дәрежесін көрсететін болса, онда оны жақшаға рим цифрымен көрсетеді. Мысалы, KNO3— калий нитраты, FeSO4—темір (II) сульфаты, Fe2(SO4)3— темір (III) сульфаты, NaCl— натрий хлориді.
Қышқылдық тұздардың атаулары анионға гидро — қосымшасын, ал егер керек болса, онда сәйкес сандарды қосу арқылы түзіледі NaHSO4—натрий гидросульфаты, КН2РО4—калий дигидрофосфаты.
Негіздік тұздардың атаулары оған сәйкес орта түздың анионының атына “гидроксо” сөзін қосу аркылы түзіледі: A1(OH)SO4—алюминий гидроксосульфаты, А1(ОН)2С1 — алюминий дигидроксохлориді.
Алынуы. Әртүрлі кластардың қосылыстары және жай заттар химиялық әрекеттескенде тұздар алынады. Тұздарды алудың маңызды жолдарын қарастырамыз:
1. Нейтралдау реакциясы:
KOH + HNO3=KNO3+H2O
2. Қышқылдардың негіздік оксидтермен әрекеттесуі.
H2SO4+CuO = CuSO4+H2O
3. Қышқылдардың тұздармен әрекеттесуі:
H2S + CuCl2=CuS↓ + 2HCl
4. Әртүрлі екі тұздың әрекеттесуі:
Na2SO4+BaCl2 = BaSO4↓ + 2NaCl
5. Негіздердің қышқылдық оксидтермен арекеттесуі.
Са(ОН)2 + СО2=СаСО3↓ + Н2О
6. Сілтілердің тұздармен әрекеттесуі:
ЗКОН + ҒеС13=ЗКС1 + Ғе(ОН)3↓
7. Негіздік оксидтердің кышқылдық оксидтермен әрекеттесуі:
CaO + SiO2 = CaSiO3
8. Металдардың бейметалдармен әрекеттесуі:
2К+С12=2КС1
9. Металдардың қышқылдармен әрекеттесуі:
2А1 + 6НС1 = 2А1С13+ЗН2↑
10. Металдардың тұздармен әрекеттесуі:
Fe+CuSO4=FeSO4+Cu
Тұздарды алудың басқа да тәсілдері бар.
Қасиеттері. Тұздар негізінен алғанда катты кристалл заттар
Суда ерігіштігі бойынша оларды ерігіш, аз ерігіш және іс жүзінде ерімейтін деп бөлуге болады.
Азот және сірке қышқылдарының барлық тұздары суда ерімтал. Тұз қышқылының AgCl, Нg2С12-ден басқа тұздары да суда ерігіш.
Тұздардың химиялық қасиеттері олардың металдарға, қышқылдарға және тұздарға қатынасы бойынша анықталады.
1. Стандартты электродтық потенциалдар қатарында әрбір бұрын тұрған металл өзінен кейінгі металдарды олардың тұздарының ерітінділерінен ығыстырады. Мысалы:
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
2. Тұздар сілтілермен әрекеттеседі:
CuSO4 + 2NaOH=Cu(OH)2↓ + Na2SO4
3. Тұздар қышқылдармен әрекеттеседі:
CuSO4+H2S = CuS↓ + H2SO4
4. Көптеген тұздар өзара әрекеттеседі:
CaCl2 + Na2CO3 = 2NaCl + CaCO3↓
1—4 реакцияларын жүргізгенде әдетте тұздардың ерітінділерін алады. Түзілетін өнімдердің біреуі реакция сферасынан кететін болса, яғни тұнбаға түссе, газ күйінде бөлінсе немесе аз диссоциацияланатын қосылыс түзсе ғана реакция аяғына дейін жүреді.
Date: 2015-11-13; view: 3304; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |