
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Бор бойынша атомның электрон қабаттарының құрылысы
Жарықтың кванттық теориясы негізінде Бор келесідей қорытынды жасады: атомдағы электрондар энергиясы үздіксіз өзгермейді, секіріс арқылы яғни дискретті өзгереді. Сондықтан атомдағы электрондардың кез келген энергетикалық жағдайлары емес, олардың тек бекітілген жағдайлары болады. Басқаша айтқанда, атомдағы электрондардың энергетикалық жағдайлары квантталған. Бір бекітілген жағдайдан екішісіне өту кезінде электромагниттік сәуле бөлінеді не сіңіріледі.
Бор теориясының негізгі қағидаларын постулаттар (постулат – дәлелсіз қабылданатын тұжырымдар) түрінде берді:
1. Электрон ядроны айналу кезінде тек белгілі орбиталар бойымен қозғалады. Бұл орбиталар стационарлы деп аталады.
2. Стационарлы орбиталармен қозғалғанда электрон электромагниттік сәулелену бөлмейді.
3. Электрон бір стационар орбитадан екіншісіне ауысқанда сәулелену байқалады. Сол кезде электромагниттік сәуле бөлінеді немесе сіңіріледі, оның энергиясы атомның соңғы және бастапқы күйінің айырмасына тең.
Соңғы тұжырымдама біршама түсініктемені қажет етеді. Ядро айнала қозғалатын электрон энергиясы орбита ядросына тәуелді. Ядроға жақын орналасқан орбитада электрон энергиясы аз болады. Электронды ядродан алыс орбитаға ауыстыру үшін, электронның оң зарядталған ядромен тартылыс күшін үзу керек, бұл энергияның жұмсалуын қажет етеді. Аталған үрдісте жарық кванты сіңіріледі. Осыған сәйкес айтылған жағдайда атом энергиясы артады да, қозған күйге ауысады. Электронның кері бағытқа ауысуы (алыс орбитадан жақын орбитаға) атом энергиясының азаюына әкеледі, энергия электромагниттік сәуле кванты түрінде бөлінеді. Электронның ауысу энергиясы келесі теңдеумен өрнектеледі:
Е = Еб – Ес,
мұндағы Еб – бастапқы (ядродан алыс орналасқан) орбитадағы электрон энергиясы, Ес – соңғы (ядроға жақын орналасқан) орбитадағы электрон энергиясы. Планк теңдеуін ескерсек Е=hv, онда hv=Еб-Ес, бұдан v=(Еб –Ес)/h.
Соңғы теңдеу бойынша сәулелердің жиіліктерін немесе толқын ұзындықтарын есептеуге болады, яғни атом спектрін есептеп табуға мүмкіндік бар.
Бор постулаттары классикалық физика ережелеріне қарама –қайшы келді. Классикалық механика тұрғысынан электрон кез келген орбитада қозғала алады, ал классикалық электродинамика зарядталған бөлшектің шеңбер бойымен орбитада сәулеленбей қозғалуын мойындамайды. Алайда бұл постулаттардың дұрыстығын сутегі атомы спектрін есептеу кезінде алынған нәтижелер анықтайды.
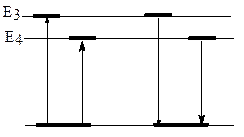 Cурет 3.4. Сызықтық спектрлердің түзілуі
Cурет 3.4. Сызықтық спектрлердің түзілуі
Бор теориясы атом спектрлерінің физикалық табиғатын атомдағы электрондардың бір стационарлы орбитадан екіншісіне ауысу нәтижесі ретінде түсіндірді (сурет 3.4).
Электронның энергиясы артық деңгейге ауысуы атом энергияны сіңірген кезде жүзеге асырылады. Электрон энергиясы азайғанда энергия бөлінеді. Энергияның өзгерісі тең болады:
ΔЕ1=Е2–Е1=hv1 және ΔЕ2=Е3–Е1=hv2.. ΔΕ2>ΔΕ1 болғандықтан, онда ν 2> ν1. Сәуленің жиілігі электронның ауысуы кезінде бөлінген немесе сіңірілген энергия мәнінен байланысты. Сонымен Бордың атом құрылысы моделі сызықтық спектрлердің пайда болуын және сутегі атомдары бөліну спектрлерінің көріну аймағындағы серияларды түсіндірді.
Алайда теорияда ішкі қарама-қайшылықтар болды: механика және электродинамика заңдарына сәйкес келмейтін постулаттармен қатар, Бор теориясында бұл заңдар атомдағы электронға әсер етуші күштерді есептеу үшін қолданылды. Постулатпен байланысты сұрақтар пайда болды; мысалы, электрон бір орбитадан екіншісіне ауысқанда қайда болады? Салыстырмалық теориясына сәйкес, бірде бір физикалық үрдіс жарық жылдамдығынан артық жылдамдықпен жайыла алмайды. Сондықтан электронның жаңа орбитаға ауысу үрдісі қас-қағымда жүре алмайды, ол белгілі бір уақытта жүзеге асады. Осы уақыт ішінде электрон бастапқы және соңғы орбиталардың аралығында болады. Алайда теория осындай “аралық” жағдайларды рұқсат етпейді.
Сонымен, Бор теориясына басқа ғалымдар толықтырулар енгізгенімен, электронның атомда тек шеңбер тәріздес орбита бойымен ғана емес, кеңістікте әртүрлі орналасқан эллипс тәріздес орбиталармен қозғалатын мүмкіндігі қарастырылды. Аталған теория көп электронды атомдардағы, тіпті сутегі атомындағы спектрлік сипаттамаларды түсіндіре алмады. Мысалы, сутегі атомы спектріндегі сызықтардың әртүрлі интенсивтігінің мәні түсініксіз болды, атом спектрлері жеке сызықтарының бірнеше бөліктерге ыдырауы түсіндірілмеді.
Көпэлектронды атомдардың мөлшерлік есептеулері өте күрделі болды. Теория сутегі атомының магниттік қасиетін қате сипаттап, молекуладағы химиялық байланыстың түзілуін түсіндірмеді.
Осының бәріне қарамастан Бор теориясы атом құрылысы туралы түсініктердің дамуында маңызды кезең болды. Планк- Энштейн гипотезасымен қатар теория үлкен денелерге –макроэлемент объектілеріне қолданылатын табиғат заңдарын микроэлементтерге – атомдар, электрондар, фотондар – қолдануға болмайтындығын көрсетті.
Date: 2015-11-13; view: 1705; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |