
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическая связь в комплексных соединених и их строение
В кристаллических комплексных соединениях с заряженными комплексами связь между комплексом и внешнесферными ионами – ионная, связи между остальными частицами внешней сферы – межмолекулярные (в том числе и водородные). В молекулярных комплексных соединениях связь между комплексами межмолекулярная.
В большинстве комплексных частиц между центральным атомом и лигандами связи ковалентные. Все они или их часть образованы по донорно-акцепторному механизму. В наименее прочных комплексах (например, в аквакомплексах щелочных и щелочноземельных элементов, а также аммония) лиганды удерживаются электростатическим притяжением. Связь в комплексных частицах часто называют донорно-акцепторной или координационной связью.
Рассмотрим ее образование на примере аквакатиона железа(II). Этот ион образуется по реакции:
FeCl2кр + 6H2O = [Fe(H2O)6]2+ + 2Cl_
Электронная формула атома железа – 1 s 22 s 22 p 63 s 23 p 64 s 23 d 6. Составим схему валентных подуровней этого атома:

При образовании двухзарядного иона атом железа теряет два 4 s -электрона:
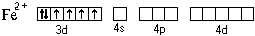
Ион железа акцептирует шесть электронных пар атомов кислорода шести молекул воды на свободные валентные орбитали:

Образуется комплексный катион, химическое строение которого можно выразить одной из следующих формул:

Пространственное строение этой частицы выражается одной из пространственных формул:
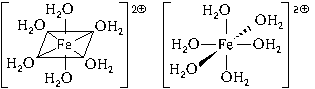
Форма координационного полиэдра – октаэдр. Все связи Fe-O одинаковые. Предполагается sp 3 d 2-гибридизация АО атома железа. Магнитные свойства комплекса указывают на наличие неспаренных электронов.
Если FeCl2 вводить в раствор, содержащий цианид-ионы, то протекает реакция
FeCl2кр + 6CN  = [Fe(CN)6]4
= [Fe(CN)6]4  + 2Cl
+ 2Cl  .
.
Тот же комплекс получается и при добавлении к раствору FeCl2 раствора цианида калия KCN:
[Fe(H2O)6]2+ + 6CN- = [Fe(CN)6]4- + 6H2O.
Это говорит о том, что цианидный комплекс прочнее аквакомплекса. В цианидном комплексе отсутствуют неспаренные электроны у атома железа. Все это связано с несколько иным электронным строением этого комплекса:

Более «сильные» лиганды CN  образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы «нарушить» правило Хунда и освободить 3 d -орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d 2 sp 3.
образуют более прочные связи с атомом железа, выигрыша в энергии хватает на то, чтобы «нарушить» правило Хунда и освободить 3 d -орбитали для неподеленных пар лигандов. Пространственное строение цианидного комплекса такое же, как и аквакомплекса, но тип гибридизации другой – d 2 sp 3.
"Сила" лиганда зависит прежде всего от электронной плотности облака неподеленной пары электронов, то есть, она увеличивается с уменьшением размера атома, с уменьшением главного квантового числа, зависит от типа гибридизации и от некоторых других факторов. Важнейшие лиганды можно выстроить в ряд по возрастанию их «силы» (своеобразный «ряд активности» лигандов), который называется спектрохимическим рядом лигандов:
| I─; Br─;:SCN─, Cl─, F─, OH─, H2O;:NCS─ NH3; SO3S:2─;:CN─, CO |
Для комплексов [Fe(H2O)6]3  и [Fe(CN)6]3
и [Fe(CN)6]3  схемы образования выглядят следующим образом:
схемы образования выглядят следующим образом:

| 
|
Для комплексов с координационным числом = 4 возможны две структуры: тетраэдр (в случае sp3 -гибридизации), например, [Zn(H2O)4]2+, и плоский квадрат (в случае dsp 2-гибридизации), например, [Cu(NH3)4]2+.
Date: 2015-12-11; view: 376; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |