
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение Нернста
Потенциал металлического электрода зависит от природы металла, концентрации (активности) ионов металла в растворе, температуры.
Если условия отличаются от стандартных, например, если концентрация ионов металла в растворе не равна 1 моль/л, то электродный потенциал металла не является стандартным и его либо определяют экспериментально, либо вычисляют.
При экспериментальном определении составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод (рис 8.2):
(катод) Pt, H2/2H+ 

 || Men+/Me (анод),
|| Men+/Me (анод),
и определяется его электродвижущая сила как разность равновесных потенциалов катода и анода (ЭДС=│Ек−Еа│). Так как потенциал стандартного водородного электрода равен нулю (Е o  =0,00 В), то ЭДС элемента будет равна потенциалу измеряемого электрода.
=0,00 В), то ЭДС элемента будет равна потенциалу измеряемого электрода.
Для вычисления электродного потенциала в нестандартных условиях применяют уравнение Нернста:
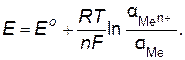 (8.1)
(8.1)
Так как металл – твердое вещество и вступает в реакцию только с поверхности, его концентрация постоянна и не должна входит в уравнение. Поэтому для вычисления электродных потенциалов металла уравнение Нернста приобретает более простой вид:
 (8.2)
(8.2)
где Ео – стандартный электродный потенциал, В; R – газовая постоянная, равная 8,314 Вт-с/моль∙К; Т − температура, К; n − число электронов, участвующих в окислительно-восстановительном процессе; F –число Фарадея, равное 96500 Кл/моль; 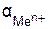 – активность ионов металла,моль/л.
– активность ионов металла,моль/л.
При подстановке числовых значений R, F и стандартной температуры Т = 298 К и при переходе к десятичным логарифмам, уравнение Нернста принимает еще более простой вид:
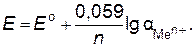 (8.3)
(8.3)
Уравнение Нернста для разбавленных растворов, в которых активности мало отличаются от концентраций (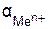
 [Men+]), имеет вид:
[Men+]), имеет вид:
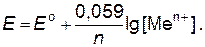 (8.4)
(8.4)
Date: 2015-10-19; view: 467; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |