
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Равновесный состав смеси и направление реакции
Упомянутый выше "коэффициент реакции" Q (другие обозначения, встречающиеся в литературе - 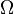 или
или  , "произведение реакции")
, "произведение реакции")

отражает соотношение текущих активностей всех участников реакции и может быть использован для определения направления реакции в момент, для которого известен Q [4]
Если в момент t коэффициент Q > K, то текущие активности продуктов больше равновесных, и значит они должны уменьшиться к тому моменту, когда установится равновесие, то есть в данный момент протекает обратная реакция;
Если Q = K, то равновесное состояние достигнуто и скорости прямой и обратной реакций равны;
Если Q < K, то 
С использованием величины  записывается уравнение изотермы химической реакции [1]
записывается уравнение изотермы химической реакции [1]

Где  - стехиометрические коэффициенты (для продуктов - со знаком "+", для исходных веществ - со знаком "-"; так же, как и в выражениях для Q и K), а
- стехиометрические коэффициенты (для продуктов - со знаком "+", для исходных веществ - со знаком "-"; так же, как и в выражениях для Q и K), а  - химические потенциалы а стандартная энергия Гиббса и стандартная константа суть
- химические потенциалы а стандартная энергия Гиббса и стандартная константа суть
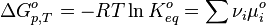
Где 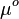 - стандартные химические потенциалы
- стандартные химические потенциалы
Уравнение изотермы показывает, как величина Q связана с изменением свободной энергии реакции:
при 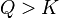 для прямой реакции
для прямой реакции 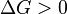 , то есть
, то есть 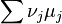 для продуктов прямой реакции больше, чем для исходных веществ - это означает, что прямая реакция запрещена (значит, не запрещена обратная);
для продуктов прямой реакции больше, чем для исходных веществ - это означает, что прямая реакция запрещена (значит, не запрещена обратная);
при  для прямой реакции
для прямой реакции  , то есть реакция достигла равновесного состояния;
, то есть реакция достигла равновесного состояния;
при 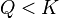 для прямой реакции
для прямой реакции  , то есть эта самопроизвольное протекание этой реакции разрешено
, то есть эта самопроизвольное протекание этой реакции разрешено
Величина  по определению имеет смысл только для состояния равновесия, то есть для состояния с
по определению имеет смысл только для состояния равновесия, то есть для состояния с  и
и  . Величина
. Величина  ничего не говорит о скоростях реакций, но она описывает состав системы в состоянии равновесия.
ничего не говорит о скоростях реакций, но она описывает состав системы в состоянии равновесия.
Если K >> 1, то в системе преобладают продукты (прямой) реакции
Если K << 1, то в системе преобладают исходные вещества (продукты обратной реакции)[5]
Date: 2015-10-19; view: 432; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |