
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Термодинамическое описание равновесия
Наряду с обозначением Q для соотношения активностей веществ в произвольный момент реакции t ("коэффициент реакции")
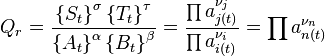
(обозначения для приведённой ниже реакции; последнее равенство написано в обозначении, что стехиометрические коэффициент берутся со знаком "+" для продуктов и со знаком "-" для исходных веществ)
в химической термодинамике используется обозначение Keq для такого же по форме соотношения между равновесными активностями веществ

(то есть соотношения активностей в момент  , в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь Keq со стандартной энергией Гиббса процесса.
, в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь Keq со стандартной энергией Гиббса процесса.
В системе, где протекает химическая реакция

равновесие может быть описано условием
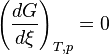
где  есть химическая переменная
есть химическая переменная
или, то же самое условие равновесия может быть записано с использованием химических потенциалов как

где химические потенциалы

здесь {A} - строго говоря, активность реагента A; при допущениях об идеальных газах можно заменить их на давления, для реальных газов можно заменить на фугитивности, при допущении о том, что раствор подчиняетсязакону Генри, можно заменить на мольные доли, и при допущении, что раствор подчиняется закону Рауля - напарциальные давления; для системы в равновесии может быть заменена на равновесную молярную концентрациюили на равновесную активность.
Выражение для энергии Гиббса принимает вид

а так как  , можно записать выражение для производной изобарного потенциала по химической переменной в виде
, можно записать выражение для производной изобарного потенциала по химической переменной в виде

При равновесии (иначе говоря, при условии что время  )
)

Записав теперь условие равновесия  найдём связь
найдём связь  со стандартной энергией Гиббса[3]:
со стандартной энергией Гиббса[3]:

Date: 2015-10-19; view: 439; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |